
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、加入盐酸,产生白色沉淀,则试样中一定有Ag+ |
| B、加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入硫氰化钾溶液无变化,滴加氯水后溶液变红色,则试样中一定有Fe2+ |
| D、加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于40mL |
| B、等于40mL |
| C、大于40mL |
| D、等于10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH3 |
| B、CH3CH2COCH2CH3 |
| C、CH3CH2OH |
| D、CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯丙烷与NaOH溶液共热后,再加入AgNO3溶液,检验溶液中的氯离子 |
| B、苯酚沾在手上,立即用NaOH溶液清洗,然后再用大量的水冲洗 |
| C、纯净的苯酚是粉红色晶体,65℃以上时能与水互溶 |
| D、配制银氨溶液时,将氨水慢慢滴到AgNO3溶液中,直到最初产生的沉淀恰好溶解为止 |
| E、可用稀硝酸清洗做完银镜反应后的试管 |
| F、向苯酚溶液中加入少量的FeCl3溶液有紫色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、HCO3-、SO32- |
| B、Ca2+、CO32-、Cl- |
| C、Ba2+、Na+、AlO2- |
| D、Fe3+、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
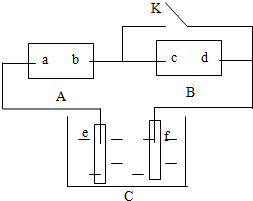 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ Na+ OH- Cl- |
| B、Mg2+ Na+ SO42- OH- |
| C、H+ Na+ Cl- CO32- |
| D、Ba2+ Cu2+ Cl- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com