
����Ŀ�����Ȼ�������ȡ�����Ѻ��Ȼ����Ѱ�(��������)����Ҫԭ�ϣ������������Ϻ����л��������Լ��������õ���Ļ����ͬʱҲ����ȡ���캽�չ�ҵ���������ѺϽ����Ҫԭ�ϣ���������(��Ҫ�ɷ���FeTiO3����������Fe2O3��SiO2��Al2O3������)���Ʊ�TiCl4�Ȳ�Ʒ��һ�ֹ����������£�

��֪��
��.���м�����м������Һ����ɫ����ʱ��Һ�Գ�ǿ���ԡ��ù����������·�Ӧ������
2Fe3++Fe===3Fe2+��2TiO2+(��ɫ)+Fe+4H+===2Ti3+(��ɫ)+Fe2++2H2O��Ti3+(��ɫ)+ Fe3++ H2O===2TiO2+(��ɫ)+ Fe2++2H+��
��.���Ȼ��ѵ��۵�-25.0�����е�136.4����SiCl4���۵�-68.8�����е�57.6����
�ش��������⣺
(1)���������ʱ��Ϊʹ������ʼӿ죬�ɲ�ȡ�Ĵ�ʩ�ǣ�________________(����д2��)��������Ҫ��Ӧ�����ӷ���ʽΪ��___________��
(2)�����ijɷ���_______��
(3)��μ��鸻��TiO2+��Һ���Ƿ���Ԫ��_____________��
(4)�����ƵõĹ���TiO2��nH2O������ϴ��ȥ���е�Fe(OH)3���ʣ������Ƶ��Ѱۡ���֪25��ʱ��Ksp[Fe(OH)3]=4.0��10-38�����¶��·�Ӧ![]() ��ƽ�ⳣ��K=____��
��ƽ�ⳣ��K=____��
(5)�������վ��гɱ��͡����õ�Ʒλ����Ϊԭ�ϵ��ŵ㡣������ɫ��ѧ����ù��������д��ڵIJ���֮����_______(ֻҪ��д��һ��)��
(6)Ҫ���ƺ�����SiCl4���ʵ�TiCl4���ɲ��õķ�����_______��
(7)��TiCl4ˮ������TiO2��nH2O�������ˡ�ˮϴ��ȥ���е�Cl�����ٺ�ɡ����ճ�ȥˮ�ֵõ�����TiO2��д��TiCl4ˮ������TiO2��nH2O�Ļ�ѧ����ʽ__________________��
���𰸡��ʵ���������Ũ�ȣ��ʵ������¶ȣ����衢��С������������ FeTiO3+4H+=Fe2++TiO2++2H2O SiO2 ȡ������Һ������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����Һ�в�����Ԫ�� 4.0��104 û�ж������������к����Ĵ�������������õ� ����(�����) TiCl4+(n+2)H2O![]() TiO2��nH2O+4HCl
TiO2��nH2O+4HCl
��������
������(��Ҫ�ɷ���FeTiO3����������Fe2O3��SiO2��Al2O3������)�����������ᣬ�õ�������Ϊ���������SiO2���õ���TiO2+��Fe2+��Fe3+��Al3+�����ӵ�ǿ���Խ���Һ����������������������Һ����ɫ����Ԫ��ת��ΪFe2+����ϵ�д����õ��̷�����TiO2+����Һ������Һ�м���ˮ�ٽ�TiO2+��ˮ�⣬����TiO2��nH2O�����շֽ�õ�TiO2��������������̿��Ϸ�Ӧ�õ�TiCl4��������Ҫ�Ƕ�����̼��
(1)�ʵ���������Ũ�ȣ��ʵ������¶ȣ����衢��С�����������ȶ����Լӿ��ȡ���ʣ��ù�����Ҫ����FeTiO3������ķ�Ӧ��������Ŀ��Ϣ��֪��Ӧ������TiԪ������TiO2+�����Ԫ���غ�͵���غ�ɵ����ӷ���ʽΪFeTiO3+4H+=Fe2++TiO2++2H2O��
(2)���������������SiO2;
(3)��Ԫ�ؿ�����Fe2+��Fe3+����ʽ���ڣ�ȡ������Һ������KSCN��Һ��������죬��Fe3+���ټ�����ˮ����Ȼ����죬��Fe2+������˵����Һ�в�����Ԫ�أ�
(4)Fe(OH)3+3H+![]() Fe3++3H2O��ƽ�ⳣ��K=
Fe3++3H2O��ƽ�ⳣ��K=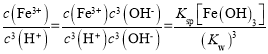 =
=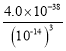 =4.0��104��
=4.0��104��
(5)����ͼʾ���ù��������д��ڵIJ���֮���ǣ������еķ�������Һ������û�н��к����Ĵ�������������õȣ�
(6)���Ȼ��ѵ��۵�-25.0�����е�136.4����SiCl4���۵�-68.8�����е�57.6�������ߵķе����ϴ����Կ����÷���ķ������룻
(7)TiCl4ˮ������TiO2��nH2O�Ļ�ѧ����ʽΪTiCl4+(n+2)H2O![]() TiO2��nH2O+4HCl��
TiO2��nH2O+4HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶���22% ��������Һ150 mL������100 gˮϡ�ͺ���������������Ϊ14%��
��1��ԭ��������Һ��������__________��
��2��ԭ��������Һ�����ʵ���Ũ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������1mol��ѧ�������γ���̬ԭ������Ҫ��������![]() ��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
���ۼ� | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. �������ȶ��Ĺ��ۼ���H-F��
C. H2(g)��2H(g) ��H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) ��H=-25kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50mol��L��1 NaOH��Һ��0.50mol��L��1������Һ���з�Ӧ�ȵIJⶨ��
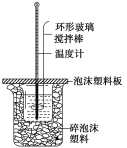
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ[����1 molH2O(l)ʱ�ķ�Ӧ��Ϊ��57.3 kJ��mol��1]��___��
��2��ȡ50 mLNaOH��Һ��30 mL ������Һ����ʵ�飬ʵ�����������
������д���еĿհף�
�¶� �������� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ(t2��t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�ڽ�����Ϊ0.50mol��L��1NaOH��Һ��0.50mol��L��1������Һ���ܶȶ���1.0g��mL��1���кͺ�������Һ�ı�����c��4.18J/(g����)��������1 mol H2O(l)ʱ�ķ�Ӧ����H��___(ȡС�����һλ)��
������ʵ����ֵ����룭57.3kJ��mol��1��ƫ�����ƫ���ԭ������(����ĸ)___��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ����С��Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬�ò�ͬ�ķ�����������ʵ�飬��ͼ����ʾ��
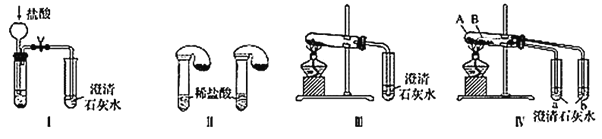
(1)ֻ����ͼ����ʾʵ�飬�ܹ��ﵽʵ��Ŀ�ĵ���________(��װ�����)��
(2)ͼ����ʾʵ����ܼ������������ʣ��䷴Ӧ�Ļ�ѧ����ʽΪ__________����ʵ�����ȣ�ʵ������ŵ���_____(����ĸ)��
A.���Ȣ���
B.���Ȣ�ȫ
C.���Ȣ�������
D.������������һ��װ��ͬʱ���������Ա�ʵ�飬������
(3)����ʵ�����֤̼���ƺ�̼�����Ƶ��ȶ��ԣ����Թ�B��װ��Ĺ��������________(�ѧʽ)��ʵ������е�����Ϊ__________��
(4)�������Ϸ����������پٳ�һ��������ߵķ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��1.92 g Cu����һ����ŨHNO3��Ӧ����Cu��ȫ��Ӧʱ���ռ�����״����1.12L���壬����������________mol������NO2________mol��
(2)����Cu�м������������Ļ�����Һ��ȡCuSO4��Һ��������������������������ʵ���֮��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ۺ���۵Ļ���ﹲ�ȣ���ַ�Ӧ����ȴ���ټ���������ϡ���ᣬ�õ���״���µ�����11.2 L����ԭ�������ܵ������(n�������ʵ���)(����)
A.n(Fe)<n(S)������������44 g
B.n(Fe)>n(S)������������44 g
C.n(Fe)��n(S)����������44 g
D.n(Fe)>n(S)����������44 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݰ�����ԭ����ͭ�ķ�Ӧ������ƲⶨͭԪ�����ԭ������Ar��Cu�� (����ֵ)��ʵ�顣�ȳ�����Ӧ������ͭ������m(CuO)����Ӧ��ȫ��ⶨ������ˮ������m(H2O)���ɴ˼���Ar��Cu����Ϊ�ˣ��ṩ��ʵ���������Լ�����(������Ҫ���ظ�ѡ�ã������NH4C1��Ca(OH)2�������Բ���ʹCuO��ȫ��ԭ�İ���)��
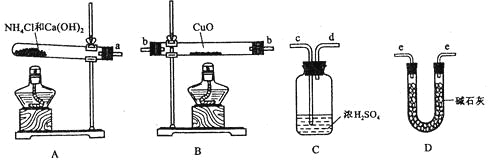
��ش��������⣺
(1)������ԭ��������ͭ�Ļ�ѧ����ʽΪ________________________________��
(2)�����ṩ���������Լ���ѡ����װ��ʵ���һ��������װ�ã����������������˳��Ϊ(��ͼ�б�ע�ĵ��ܿڷ��ű�ʾ)a��______________________________��
(3)�ڱ�ʵ���У������m(CuO)=ag��m(H2O)=bg����Ar��Cu��= _______________��
(4)�ڱ�ʵ���У�ʹ�ⶨ���Ar��Cu��ƫ�����_______________ (�����)��
��CuOδ��ȫ��Ӧ �� CuO������
��CuO�л��в���Ӧ������ �ܼ�ʯ�Ҳ�����
��NH4C1��Ca(OH)2����ﲻ����
(5)�ڱ�ʵ���У�����ͨ���ⶨ_______________��_______________����_______________��_______________�ﵽʵ��Ŀ�ġ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС������H2C2O4��Һ������KMnO4��Һ�ķ�Ӧ̽������������ĸı�Ի�ѧ��Ӧ���ʵ�Ӱ����������������ʵ�飺
ʵ����� | ʵ�� �¶�/K | �й����� | ��Һ��ɫ������ɫ����ʱ��/s | ||||
����KMnO4��Һ | H2C2O4��Һ | H2O | |||||
V/mL | c/mol��L-1 | V/mL | c/mol��L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
��1��ͨ��ʵ��A��B����̽����___(���ⲿ����)�ĸı�Ի�ѧ��Ӧ���ʵ�Ӱ�죬����V1��____��T1��____��ͨ��ʵ��___(��ʵ�����)��̽�����¶ȱ仯�Ի�ѧ��Ӧ���ʵ�Ӱ�죬����V2��____��
��2����t1��8�����ɴ�ʵ����Եó��Ľ�����_____��������Һ����ı仯������ʵ��B�����ݼ��㣬0��8s�ڣ���KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����v(KMnO4)��___��
��3����С���һλͬѧͨ���������Ϸ��֣�����ʵ�������n(Mn2+)��ʱ��ı仯�����ͼ��ʾ������Ϊ������ֱ仯��ԭ���Ƿ�Ӧ��ϵ�е�ij�����Ӷ�KMnO4�����֮��ķ�Ӧ��ij���������ã����������____����Ӧ�������������___(�����ӷ���)��
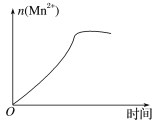
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com