
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
B.能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C.0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO3—
D.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是亚硝酸根离子与钠离子组成的工业盐,具有咸味,其水溶液呈碱性.亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.加热到320℃以上则分解,生成氧气,氮气和氧化钠,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2.
(1)人体正常的血红蛋白含有Fe2+.若误食NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是___________________________(填序号).
A.亚硝酸盐被还原 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是氧化剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号).
A.测定这两种溶液的pH B.用筷子蘸取固体品尝味道
C.加强热收集气体检验 D.用HNO3酸化的AgNO3鉴别
(3)亚硝酸钠受热分解的化学反应方程式为:4NaNO2![]() 2N2↑+3O2↑+2Na2O
2N2↑+3O2↑+2Na2O
①从氧化还原反应角度分析,该反应说明NaNO2具有_____________________.(填氧化性、还原性或者既有氧化性又有还原性)
②该反应中的还原产物为______________________(写名称)
③若反应中转移3mol电子,得到Na2O的质量为________________g.
(4)己知Cl2具有强氧化性,能将溶液中的NO2﹣氧化为NO3﹣同时生成盐酸,请写出NaNO2溶液中通入Cl2的离子反应方程式____________________________________________________________________________.
(5)某工厂废液中,含2%~5%的NaNO2,直接排放会造成污染,NH2Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为______________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3 、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
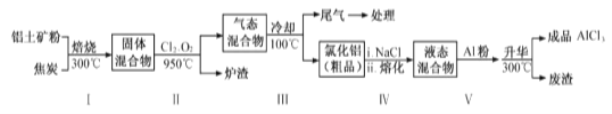
已知:

①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_____(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_________________________。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。

根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
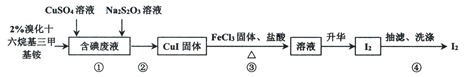
已知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法不正确的是
A.步骤①中Na2S2O3可用Na2SO3代替
B.步骤②可以用倾析法除去上层清液
C.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.高温条件下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用![]() 与
与![]() 进行下列反应:
进行下列反应:![]()
![]()
![]() ;
;![]() ,当放出
,当放出![]() 热量时,
热量时,![]() 的转化率为
的转化率为![]()
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为![]() 和
和![]() ,则
,则![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com