
【题目】同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.6kJ/mol.测得数据如表
2NH3(g) △H=-92.6kJ/mol.测得数据如表
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
(1) | 2 | 3 | 0 | 27.78kJ |
(2) | 1.6 | 1.8 | 0.8 | Q |
下列叙述不正确的是
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
【答案】B
【解析】试题分析:A、假如(2)中NH3是反应产生的,则其等效起始状态是2molN2、3molH2、0mol的NH3。二者开始状态相同。所以二者的平衡状态相同,因此平衡时两个容器内压强相等,正确; B、 N2(g)+3H2(g)2NH3(g)△H=-92.6kJ/mol
C(始)mol/L:2 3 0 92.6kJ
C(变)mol/L 1/3 1 2/3 27.78kJ
C(平)mol/L 5/3 2 2/3
K=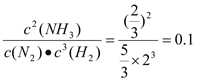
![]() 容器(2)中反应开始时,Qc=
容器(2)中反应开始时,Qc=![]()
所以反应向逆反应方向移动,v(正)<v(逆),错误;C、容器(2)中反应向逆反应方向进行最终达到平衡,所以吸收热量,由于(1)和(2)的平衡常数相同,所以容器(2)中反应达平衡时,吸收的热量Q为1/3×27.78kJ=9.26kJ,正确; D、条件为“绝热恒容”,容器(1)中反应进行中,氨气的物质的量是(27.78kJ÷92.6kJ/mol)×2=0.6mol,由于温度会升高,所以化学平衡会逆向移动,因此反应达平衡时n(NH3)<0.6mol,正确。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】将mg Al2O3和Fe2O3的混合物溶于100mL盐酸中,然后逐滴加入1mol/LNaOH溶液,其结果如图所示:
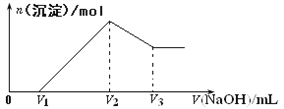
(1)最初加入V1mLNaOH溶液的作用是____________;
(2)盐酸的物质的量浓度是___________________;
(3)若mg混合物中Al2O3和Fe2O3按不同比例进行上述实验(其他条件不变),则V2的值会不会改变__________(填“会”或 “不会”),(V2—V1)的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,
最后再用蒸馏,水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.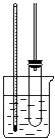
请填写下列空白:
(1)配制一定比例浓H2SO4与浓HNO3混合酸时,如何混合? .
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是;
(3)装置中常在试管上连接玻璃管,作用是什么? .
(4)步骤④中洗涤、分离粗硝基苯应使用的仪器是 .
(5)步骤④中粗产品用5% NaOH溶液洗涤的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A.金属钠投入蒸馏水2 Na+2H2O=2 Na+ +2OH- +H2↑
B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+ =SO2↑+ H2O
C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑
D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述合理的是( )
A.任何物质燃烧都必须有氧气参加
B.氢气在氯气中燃烧发出淡蓝色火焰,并在空气中产生大量白雾
C.饱和氯水在光照下有气泡产生,该气体为氯气
D.长久放置的氯水将失去漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
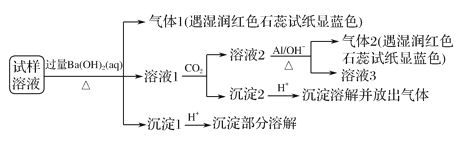
已知:3NO![]() +8Al+5OH-+2H2O
+8Al+5OH-+2H2O![]() 3NH3↑+8AlO
3NH3↑+8AlO![]() ,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中肯定存在NH![]() 、Mg2+、SO
、Mg2+、SO![]() 和NO
和NO![]()
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中下列电离方程式书写不正确的是( )
A.H2SO4=2H+ + SO42-B.KHCO3=K++ HCO3-
C.NaOH=Na+ + OH-D.NaHSO4=Na++ HSO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com