
【题目】下列说法中正确的是( )
A. 所有金属元素都分布在d区和ds区
B. 最外层电子数为2的元素都分布在s区
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. s区均为金属元素
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B=2C B.A+3B=C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的空间构型,下列结论中正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 正四面体;正四面体 D. V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)ΔH1=-67.7kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l)ΔH2=-57.3kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH3<0
下列说法正确的是( )
A. HF的电离方程式及热效应:HF(aq)![]() H+(aq)+F-(aq) ΔH>0
H+(aq)+F-(aq) ΔH>0
B. 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大
C. ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D. 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把A、B、C、D四块金属泡在稀HSO4中用导线两两相连可以组成各种原电池.若A、B相连时,A为负极:C、D相连,D上有气泡逸出;A、C相连时A极减轻:B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为
A. A>C>B>D B. A>C>D>B C. B>D>C>A D. A>B>>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如图所示装置进行实验,以探究苯与液溴发生反应的原理,并分离、提纯反应产物。
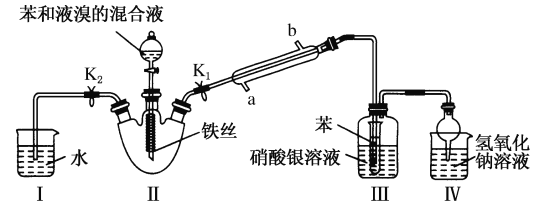
请回答下列问题:
(1)冷凝管所起的作用为________和________,冷凝水从________口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。装置Ⅲ中小试管内苯的作用是____________________________。
(3)能说明苯与液溴发生了取代反应的现象是_____________________。
(4)反应结束后,将装置I中的水倒吸入装置Ⅱ中。这样操作的目的是_______________________,
简述这一步骤的操作:_____________________________________。
(5)利用三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液 ②用5% NaOH溶液洗涤,振荡,分液 ③用蒸馏水洗涤,振荡,分液 ④加入无水CaCl2粉末干燥 ⑤________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
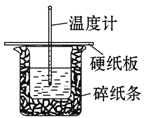
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4,7二甲基香豆素(熔点:132.6 ℃)是一种重要的香料,广泛分布于植物界中,由间甲基苯酚为原料的合成反应如下:
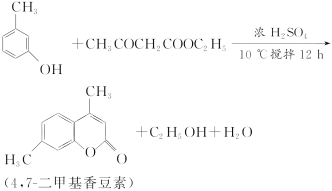
实验装置图如下:

主要实验步骤:
步骤1:向装置a中加入60 mL浓硫酸,并冷却至0 ℃以下,搅拌下滴入间甲基苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持在10 ℃下,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品。
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)简述装置b中将活塞上下部分连通的目的________________________。
(2)浓H2SO4需要冷却至0 ℃以下的原因是__________________________。
(3)反应需要搅拌12 h,其原因是_________________________________。
(4)本次实验产率为________。(百分数保留一位小数)
(5)实验室制备乙酸乙酯的化学反应方程式:_____________________________,用________(填药品名称)收集粗产品,用________(填操作名称)的方法把粗产品分离。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com