
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
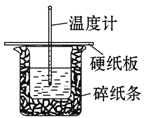
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).
【答案】(1)保温,减少实验过程中热量损失;环形玻璃搅拌棒;
(2)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-57.3kJ·mol-1;
(3)①4;②-53.5kJ·mol-1;③ac;(4)不相等;相等;偏小。
【解析】
试题分析:(1)因为此实验需要测量温度的变化,应减少热量的损失,大小烧杯之间填满碎泡沫塑料的作用起到保温的作用,减少热量的损失,缺少玻璃唤醒搅拌棒;(2)中和热是稀酸和稀碱反应生成1mol水时放出的热量,因此反应方程式为:1/2H2SO4(aq)+ NaOH(aq) =1/2Na2SO4(aq)+ H2O(l) ΔH=-57.3 kJ·mol-1;(3)①实验次数 2与其他温度差差别大,因此省略,平均温度差为(4.0+3.9+4.1)/3=4.0;②△H=-cm△t/n(H2O)=-4.18×10-3×80×4.0/50×10-3×0.5kJ·mol-1=-53.5kJ·mol-1;③a、计算出的中和热小于57.5kJ·mol-1,说明此装置保温和隔热效果差,故正确;b、量取氢氧化钠时仰视读数,测的氢氧化钠的体积增大,放出热量多,故错误;c、多次把NaOH溶液倒入硫酸中,造成热量损失,故正确;(4)因为物质的量不同,因此放出热量是不相等,中和热跟物质的量多少无关,因此中和热不变,醋酸是弱电解质,电离是吸热过程,因此反应后温度的变化值会偏小。


科目:高中化学 来源: 题型:
【题目】在给定温度和压强下的理想气体,影响其所占体积大小的主要因素是
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由实验或已有知识得出的结论错误的是( )
A.SO2可用于杀菌、消毒,但不可用来加工食品
B.液氨汽化时要吸收大量热,因此氨常用作制冷剂
C.二氧化硅与水不反应,说明二氧化硅不是酸性氧化物
D.铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 所有金属元素都分布在d区和ds区
B. 最外层电子数为2的元素都分布在s区
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. s区均为金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
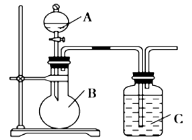
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,强酸一般能制取弱酸。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3。(不考虑硝酸的挥发性)
A、B、C中盛装的试剂分别为____________、____________、____________。C中实验现象为____________________;
写出C中发生反应的离子方程式:____________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用上图装置证明氯气氧化性强于碘单质的氧化性。A中盛装浓盐酸,B中装入高锰酸钾粉末,实验时C中溶液变成蓝色,则:C中盛装的试剂为_________________;写出C中离子方程式_____________________。该实验该装置有明显不足,请指出改进方法:__________________________。
(3)如果C中盛装饱和氢硫酸(H2S饱和水溶液),A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀。写出该反应的化学方程式:_____________;如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2 (填序号)。
A.漂白性 B.氧化性 C.还原性 D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)![]() 3C(g)+D(s)△H1>0,②xM(g)+N(g)
3C(g)+D(s)△H1>0,②xM(g)+N(g)![]() 3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.
3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.
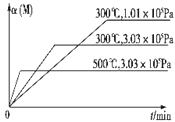
下列对W容器中进行的反应推断合理的是( )
A.x=2
B.平衡时, v 正 (B):v 逆 (C)=2:3
C.若保持容器容积不变,充入N,则C的物质的量减小
D. 若保持容器容积不变,充入Q,反应①的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是( )
A. NaOH B. MgO C. 氨水 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是( )
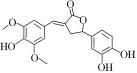
A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与4 mol NaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
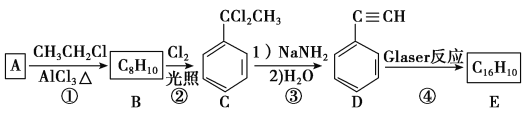
回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为________________。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气________mol。
(4)化合物( )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com