
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
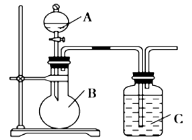
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,强酸一般能制取弱酸。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3。(不考虑硝酸的挥发性)
A、B、C中盛装的试剂分别为____________、____________、____________。C中实验现象为____________________;
写出C中发生反应的离子方程式:____________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用上图装置证明氯气氧化性强于碘单质的氧化性。A中盛装浓盐酸,B中装入高锰酸钾粉末,实验时C中溶液变成蓝色,则:C中盛装的试剂为_________________;写出C中离子方程式_____________________。该实验该装置有明显不足,请指出改进方法:__________________________。
(3)如果C中盛装饱和氢硫酸(H2S饱和水溶液),A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀。写出该反应的化学方程式:_____________;如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2 (填序号)。
A.漂白性 B.氧化性 C.还原性 D.酸性
【答案】(1)硝酸溶液 碳酸钙 硅酸钠溶液 产生白色沉淀(各1分)
CO2+SiO32-+H2O=H2SiO3↓+CO32-或CO2+SiO32-+H2O=H2SiO3(胶体)+CO32-
或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-(2分)
(2)KI淀粉溶液(1分) 2I-+Cl2=I2+2Cl-(2分)
增加装有NaOH溶液的尾气吸收装置(2分)
(3)Cl2+H2S=S↓+2HCl(2分) B(2分)
【解析】
试题分析:(1)根据较强的酸制取较弱的酸可知,A中装试剂是硝酸溶液,B中装试剂是碳酸钙,C中装试剂硅酸钠溶液。由于碳酸的酸性强于硅酸的,所以C中有白色沉淀硅酸生成,反应的方程式是CO2+SiO32-+H2O=H2SiO3↓+CO32-。
(2)酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以C中试剂是淀粉碘化钾溶液。由于氯气能把碘化钾氧化生成单质碘,所以实验现象是溶液变蓝色,反应的离子方程式是2I-+Cl2=I2+2Cl-;由于氯气有毒,所以必须增加装有氢氧化钠溶液的尾气吸收装置。
(3)高锰酸钾溶液能把盐酸氧化生成氯气,而氯气能把硫化氢氧化生成单质S沉淀,所以反应的方程式是Cl2+H2S=S↓+2HCl,这说明氯的非金属性比硫的非金属性强。如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2得到电子,体现氧化性,答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表所示:
弱酸 | HCOOH | HCN | H2CO3 |
电离平 衡常数(25 ℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项正确的是( )
A.2CN-+H2O+CO2=2HCN+CO![]()
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-)
D.c(NH![]() )相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化或过程属于化学变化的是
A. 激光法蒸发石墨得C60 B. 丁达尔效应
C. 紫色石蕊试液通过活性炭变成无色 D. 用铂丝蘸取NaCl溶液进行焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把A、B、C、D四块金属泡在稀HSO4中用导线两两相连可以组成各种原电池.若A、B相连时,A为负极:C、D相连,D上有气泡逸出;A、C相连时A极减轻:B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为
A. A>C>B>D B. A>C>D>B C. B>D>C>A D. A>B>>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月,北斗三号“一箭双星”成功发射,其定位服务让天然气管网控制更精准。天然气的主要成分是甲烷,甲烷属于 ( )
A. 无机物 B. 氧化物 C. 单质 D. 有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
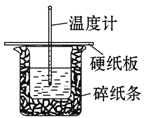
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
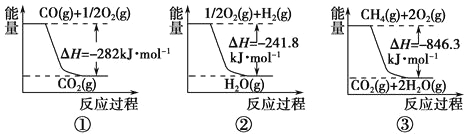
反应①②③均为____________反应(填“吸热”或“放热”)。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。为进一步提高CO2
CO(NH2)2(l)+H2O(g)。为进一步提高CO2
的平衡转化率,下列措施中能达到目的的是____________。
A.增大NH3的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
(3)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2(g)![]() NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
(NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
①第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低.因此,总反应的反应速率和转化率主要取决于___________.(填“第一步”或“第二步”)
②对于第一步反应,不能判断该反应一定达到化学平衡状态的依据是__________(填字母).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ(NH3)正=2υ(CO2)逆
C.恒容容器中气体的密度不随时间变化而变化
D.容器中各物质总质量不随时间变化而变化
③第一步反应生成了1mol氨基甲酸铵,再发生第二步反应时的转化率与温度、压强的关系如图所示:
在180℃的条件下,P2_________P3(填“>”、“<”或“=”,下同);化学平衡常数K1_________K2.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对晶体类型判断正确的是( )
选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com