
【题目】在给定温度和压强下的理想气体,影响其所占体积大小的主要因素是
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,可大量共存的离子是( )
A.K+ Na+ OH﹣ SO42﹣
B.Mg2+ SO42﹣ NH4+ Cl﹣
C.K+ Na+ HCO3﹣ Cl﹣
D.K+ Na+ NO3﹣ CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B=2C B.A+3B=C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表所示:
弱酸 | HCOOH | HCN | H2CO3 |
电离平 衡常数(25 ℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项正确的是( )
A.2CN-+H2O+CO2=2HCN+CO![]()
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-)
D.c(NH![]() )相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜的制备实验是化学实验教学中一个必做实验,某学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
(1)根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有 。
(2)该反应的化学方程式为 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)Fe2(SO4)3的作用是 。
(4)得到的混合液可以用下列四种物质中的 调节溶液的pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:
A.NaOH B. CuO C. CuCO3 D.Fe
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
实 验 (一) | 实 验 (二) | |
主要优点 | 操作简便 | (1)原料充分转化为产品 (2)没有有害气体排放 |
主要缺点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖宝宝取暖片的材料中含有铁粉、水、活性炭、硅石、食盐等它们组成一个原电池在反应时释放出热量,铁粉在原电池中充当
A. 正极 B. 负极 C. 阴极 D. 阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的空间构型,下列结论中正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 正四面体;正四面体 D. V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
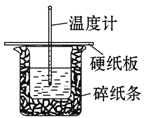
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com