
| A、△H1>0,△H2>0 |
| B、△H3<0,△H4>0 |
| C、△H3=△H1-△H2 |
| D、△H4=2△H5-3△H3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
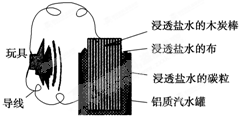
| A、铝罐将逐渐被腐蚀 |
| B、碳粒和炭棒上发生的反应为O2+4e-═2O2- |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙酸与乙醇的反应CH3COOH+CH3CH218OH
| ||||
| B、苯酚钠溶液和少量CO2反应:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | ||||
| C、用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
D、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com