
| A. | 2.3gNa变成Na+时,失去的电子数为0.2NA | |
| B. | 0.2NA个H2SO4与19.6gH3PO4含有相同的氧原子数 | |
| C. | 28gN2所含原子数为NA | |
| D. | NA个O2与NA个H2的质量比为8:1 |
分析 A、1molNa变成Na+时,失去的电子数为NA;
B、根据m=nM=$\frac{N}{{N}_{A}}$M结合物质的分子构成来计算即可;
C、根据m=nM=$\frac{N}{{N}_{A}}$M结合物质的分子构成来计算即可;
D、根据m=nM=$\frac{N}{{N}_{A}}$M来计算.
解答 解:A、2.3g即0.1molNa变成Na+时,失去的电子数为0.1NA,故A错误;
B、0.2NA个H2SO4含有相同的氧原子数为0.8NA,19.6g即0.2molH3PO4含有的氧原子数0.8NA,二者含有相同的氧原子数,故B正确;
C、28gN2所含原子数为2NA,故C错误;
D、NA个O2与NA个H2的质量比为32:2=16:1,故D错误.
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点,要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:选择题
| A. | N5+具有34个电子 | B. | N5+中氮-氮之间是以共价键结合 | ||
| C. | 化合物N5AsF6中As的化合价为+1 | D. | 化合物N5AsF6中F的化合价为-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
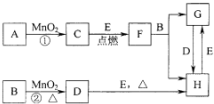 图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3++3H2O?Fe(OH)3↓+3H+ | B. | NH4++2H2O?NH3•H2O+H3O+ | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Br-+H2O?HBr+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu是金属,可与稀硫酸反应制取氢气 | |
| B. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| C. | Cu(OH)2具有弱碱性,可用于治疗人体胃酸过多 | |
| D. | Fe3+具有氧化性,可溶解印刷线路板上的金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
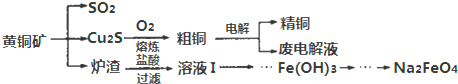
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应活化能小于169.8kJ•mol-1 | |
| B. | 逆反应活化能一定小于169.8kJ•mol-1 | |
| C. | 正反应活化能不小于169.8kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小169.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③→⑧→①←④→⑨ | B. | ⑦→③→⑥→①←④→⑨→② | C. | ②→⑨→④→①←⑥←③ | D. | ②→④→⑤→①←⑥←③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com