
| A. | N5+具有34个电子 | B. | N5+中氮-氮之间是以共价键结合 | ||
| C. | 化合物N5AsF6中As的化合价为+1 | D. | 化合物N5AsF6中F的化合价为-1 |
分析 A.阳离子电子数=质子数-电荷数;
B.非金属元素之间易形成共价键;
C.N5AsF6中阳离子是N5+,则阴离子是AsF6-,AsF6-中F元素显-1价;
D.氟元素是最活泼的非金属元素,F原子最外层有7个电子,容易得1个电子变成8电子稳定结构.
解答 解:A.阳离子电子数=质子数-电荷数=5×7-1=34,故A正确;
B.非金属元素之间易形成共价键,N5+中氮-氮之间是以共价键结合,故B正确;
C.N5AsF6中阳离子是N5+,则阴离子是AsF6-,AsF6-中F元素显-1价,所以As元素显+5价,故C错误;
D.氟元素是最活泼的非金属元素,F原子最外层有7个电子,容易得1个电子变成8电子稳定结构,所以该化合物中F元素为-1价,故D正确;
故选C.
点评 本题考查化学键、电子数的计算、化合价判断等知识点,侧重考查学生分析计算能力,明确化学键概念、电子数的计算方法及化合价判断方法即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,Cu为负极,CuCl2溶液作为电解质溶液 | |
| B. | Zn为负极,Cu为正极,稀H2SO4溶液作为电解质溶液 | |
| C. | Zn为负极,Cu为正极,CuSO4溶液作为电解质溶液 | |
| D. | Zn为负极,Fe为正极,Zn发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
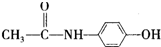 ,从下简称F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成:
,从下简称F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成: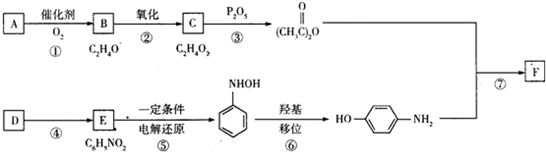
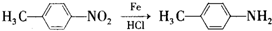
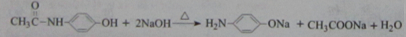 .
.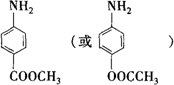 .
.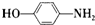 的合成路线
的合成路线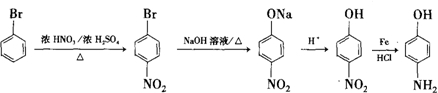 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
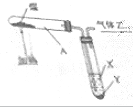
| A. | 该实验中发生了复杂的物理化学变化 | |
| B. | 液体X的pH>7 | |
| C. | Z易燃,可还原CuO | |
| D. | 试管A中产生了大量的白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3gNa变成Na+时,失去的电子数为0.2NA | |
| B. | 0.2NA个H2SO4与19.6gH3PO4含有相同的氧原子数 | |
| C. | 28gN2所含原子数为NA | |
| D. | NA个O2与NA个H2的质量比为8:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com