
| A、将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 |
| B、将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 |
| C、将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去 |
| D、将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
| △ |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
 近年来,全球气候变暖给人类生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视.下列有关说法不正确的( )
近年来,全球气候变暖给人类生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视.下列有关说法不正确的( )| A、太阳能、地热能、生物质能和核聚变能均属于“新能源” |
| B、“低碳”是指采用含碳量低的烃类作为燃料 |
| C、如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想 |
| D、让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | |
| C | D |
| A、原子半径:A>B |
| B、C的最简单氢化物的分子构型为平面三角形 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、SiO2可溶解在溶有HB的溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
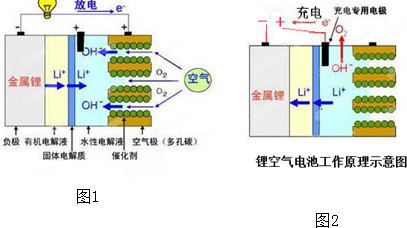
| A、锂空气电池配置了充电专用的阳极,可防止充电时空气极发生腐蚀和劣化.由于有固体电解质膜的存在,比普通锂电池更安全 |
| B、该电池放电时正极反应式为:O2+2H2O+4e-═4OH-.由于正极材料来源于空气,整个电池质量相同时,锂空气电池比普通锂电池能提供更多的电能 |
| C、锂空气电池电放完后也可以不必进行充电,只需要通过更换正极的水性电解液,并以合适的方式补给负极的金属锂,就可以连续使用 |
| D、在电池工作过程中,锂空气电池的空气极(多孔碳)附近电解液的pH逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电源左极为正极 |
| B、电解槽左侧的电极反应方程式为:2H2O-4e-═O2+4H+ |
| C、D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大 |
| D、在标准状况下,若1min后从C口处收集到的气体比B口处收集到的气体多2.24L,则有0.1NA个SO42-通过阴离子膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 利用图除去乙烷中的乙烯 |
B、 利用图比较单质S、Cl2的氧化性 |
C、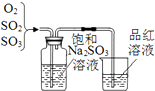 利用图检验硫酸铜晶体受热分解气体中的二氧化硫 |
D、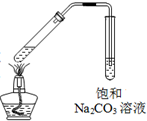 利用图实验室加热浓硫酸、乙醇和乙酸制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液化石油气的主要成分是甲烷 |
| B、不锈钢餐具和目前流通的硬币都属于合金 |
| C、医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡 |
| D、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:K+,ClO-,Ba2+,Cl- |
| B、水电离c(H+)═10-12mol?L-1的溶液中:Cl-,CO32-,NO3-,NH4+ |
| C、使甲基橙变红的溶液中:Fe2+,MnO4-,NO3-,Na+ |
| D、中性溶液中:Al3+,NO3-,Cl-,S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com