
| ||
 ,故答案为:D;
,故答案为:D; .
.


科目:高中化学 来源: 题型:
| A、将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 |
| B、将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 |
| C、将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去 |
| D、将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、该溶液中可能存在:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| C、向该溶液中滴入少量稀盐酸,一定会产生气泡 |
| D、向该溶液中滴入少量Ca(OH)2溶液,一定会有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
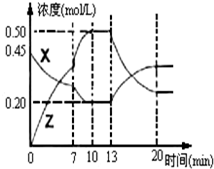 I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题:
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com