
| A、该溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、该溶液中可能存在:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| C、向该溶液中滴入少量稀盐酸,一定会产生气泡 |
| D、向该溶液中滴入少量Ca(OH)2溶液,一定会有白色沉淀产生 |


科目:高中化学 来源: 题型:
| A | B | |
| C | D |
| A、原子半径:A>B |
| B、C的最简单氢化物的分子构型为平面三角形 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、SiO2可溶解在溶有HB的溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液化石油气的主要成分是甲烷 |
| B、不锈钢餐具和目前流通的硬币都属于合金 |
| C、医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡 |
| D、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:K+,ClO-,Ba2+,Cl- |
| B、水电离c(H+)═10-12mol?L-1的溶液中:Cl-,CO32-,NO3-,NH4+ |
| C、使甲基橙变红的溶液中:Fe2+,MnO4-,NO3-,Na+ |
| D、中性溶液中:Al3+,NO3-,Cl-,S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铁电极发生的电极反应式为:Fe-2e-=Fe2+ |
| B、通入甲烷的电极反应式为:CH4+4CO32--8e-=5CO2+2H2O |
| C、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D、若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
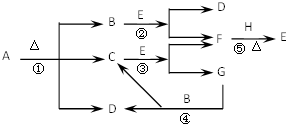 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.| 氧化剂: | Na2O2 | 还原剂: | Na2O2 |
| 氧化产物: | O2 | 还原产物: | H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com