
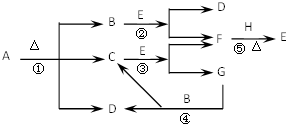
 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.| 氧化剂: | Na2O2 | 还原剂: | Na2O2 |
| 氧化产物: | O2 | 还原产物: | H2O |
| ||
| ||
| ||
| ||
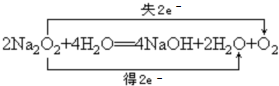 ,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑, ;
; | 氧化剂: | Na2O2 | 还原剂: | Na2O2 |
| 氧化产物: | O2 | 还原产物: | H2O |


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、该溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、该溶液中可能存在:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| C、向该溶液中滴入少量稀盐酸,一定会产生气泡 |
| D、向该溶液中滴入少量Ca(OH)2溶液,一定会有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次序 | 盐酸 | 剩余固体 |
| 1 | 先加入5.00mL | 1.32g |
| 2 | 再加入5.00mL | 0.64g |
| 3 | 再加入5.00mL | 0.20g |
| 4 | 再加入5.00mL | 0.20g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是
某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是查看答案和解析>>
科目:高中化学 来源: 题型:
 I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题:
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com