
 某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是
某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是| 1mol |
| 2 |
| 1mol |
| 2 |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
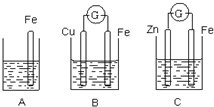 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:
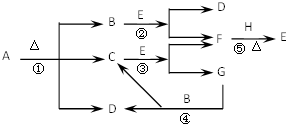 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.| 氧化剂: | Na2O2 | 还原剂: | Na2O2 |
| 氧化产物: | O2 | 还原产物: | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
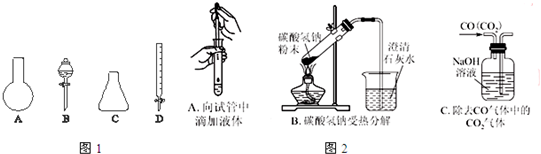
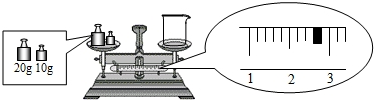
查看答案和解析>>
科目:高中化学 来源: 题型:
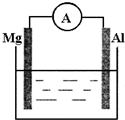 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、②③⑤⑦ |
| C、②⑤⑥ | D、②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com