
【题目】侯德榜制碱法生产流程为:
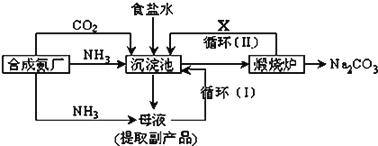
![]() 沉淀池中反应的化学方程式:________________________________;
沉淀池中反应的化学方程式:________________________________;
![]() 检验产品碳酸钠中是否含有氯化钠的操作方法为:___________________________
检验产品碳酸钠中是否含有氯化钠的操作方法为:___________________________
![]() 上述流程中物质X的分子式为 ______
上述流程中物质X的分子式为 ______
【答案】![]() 用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,若不生成沉淀,则无氯化钠
用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,若不生成沉淀,则无氯化钠 ![]()
【解析】
(1)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(2)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银;
(3)循环Ⅱ是利用碳酸氢钠分解生成的二氧化碳通入沉淀池循环使用。
(1)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,若不生成沉淀,则无氯化钠;故答案为:用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,若不生成沉淀,则无氯化钠;
(3)循环Ⅰ是将未反应的氯化钠返回沉淀池中,煅烧碳酸氢钠时生成二氧化碳、二氧化碳能循环利用,所以X是![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )

A.反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4转移12 mol电子
3H2+CO,每消耗1 mol CH4转移12 mol电子
B.电极A上H2参与的电极反应为H2+2OH--2e-===2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应容器中充入1molA气体和n molB气体,在一定条件下发生反应:A(气)+nB(气)![]() mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的
mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的 ![]() ,则n和m的数值可能是( )
,则n和m的数值可能是( )
A. n=1 m=1 B. n=2 m=2
C. n=3 m=3 D. n=2 m=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水,![]() 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于![]() 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮![]() 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外活动小组的同学探究影响锌与酸反应生成氢气的快慢的因素,实验如下:分别向两只烧杯中加入500mL0.4mol·L-1盐酸、500mLamol·L-1硫酸,再同时向两只烧杯中加入等质量、等大小的过量锌片(未用砂纸打磨),并开始记录数据。

(1)实验中硫酸的物质的量浓度的数值a为___。
(2)在2~6s内,Zn与盐酸的反应速率为v(H+)=__mol·L-1·s-1。
(3)在0~2s内,两溶液中的H+的物质的量浓度均下降至0.38mol·L-1,但均未得到H2,可能的原因是___。
(4)小组同学经过计算得到Zn与盐酸反应的速率随时间变化的情况。
①反应开始8s后,Zn与盐酸反应的速率逐渐减慢,原因可能是___。
②第4~6s的反应速率高于第2~4s的反应速率,原因可能是__。
(5)依据上述实验及数据推测,影响锌与酸反应生成氢气的快慢的因素有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=____,C=____,E=_____.
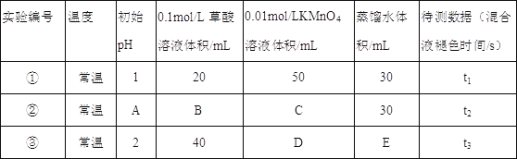
(2)该反应的离子方程式______________________________________.
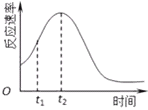
(3)若t1<t2,则根据实验①和②得到的结论是_____________________________.
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②__________________________.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:______________________________;实验中所需的定量仪器有__________________(填仪器名称).该KMnO4溶液的物质的量浓度为____mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.100 mol/L NaOH溶液滴定20.00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
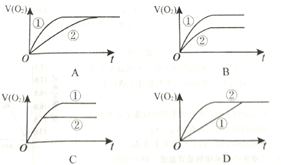
【题目】在相同条件下,做H2O2分解对比实验时,回答下面问题:
(1)其中①加人MnO2催化,②不加MnO2催化。下图是反应放出O2的体积随时间的变化关系示意图,其中正确的是_______________
(2)将质量相同但聚集状态不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条不复燃 | 30分钟 |
①写出H2O2的电子式______________发生的化学反应方程式_______________________。
②实验结果说明催化剂作用的大小与____________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/LNaOH溶液滴定25.00mL0.1000mol/L 某一元酸HX 溶液,滴定过程中pH变化曲线如图所示,下列说法不正确的是
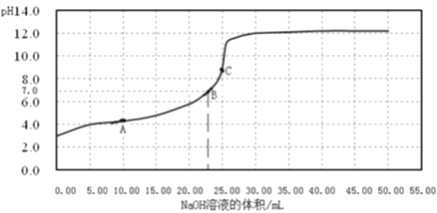
A. 在A点:c (HX)>c(Na+)>c(X-) B. 在B点,溶液中c(H+)=c(OH-)
C. 0.05mol/L NaX 溶液的pH≈9.0 D. C 点溶液中存在的主要平衡是X-+ H2O![]() HX+OH-
HX+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com