
【题目】课外活动小组的同学探究影响锌与酸反应生成氢气的快慢的因素,实验如下:分别向两只烧杯中加入500mL0.4mol·L-1盐酸、500mLamol·L-1硫酸,再同时向两只烧杯中加入等质量、等大小的过量锌片(未用砂纸打磨),并开始记录数据。

(1)实验中硫酸的物质的量浓度的数值a为___。
(2)在2~6s内,Zn与盐酸的反应速率为v(H+)=__mol·L-1·s-1。
(3)在0~2s内,两溶液中的H+的物质的量浓度均下降至0.38mol·L-1,但均未得到H2,可能的原因是___。
(4)小组同学经过计算得到Zn与盐酸反应的速率随时间变化的情况。
①反应开始8s后,Zn与盐酸反应的速率逐渐减慢,原因可能是___。
②第4~6s的反应速率高于第2~4s的反应速率,原因可能是__。
(5)依据上述实验及数据推测,影响锌与酸反应生成氢气的快慢的因素有__。
【答案】0.2 0.025 Zn被氧化,表面有ZnO消耗酸 盐酸浓度减小使反应速率减慢 盐酸与Zn反应放热,使反应速率加快 氢离子的浓度、温度以及Cl-、SO![]() 等
等
【解析】
(1)根据图1,c(H+)=0.4mol/L,每个硫酸电离产生两个氢离子,则硫酸的物质的量浓度为0.2mol/L,即数值a为0.2。
(2)在2~6s内,c(H+)由0.38mol/L降为0.28mol/L,则反应掉c(H+)=0.38mol/L-0.28mol=0.1mol/L,H+的反应速率为v(H+)=![]() =0.025mol·L-1·s-1;
=0.025mol·L-1·s-1;
(3)锌为活泼金属,表面有氧化锌,所以可能的原因是Zn被氧化,表面有ZnO消耗酸;
(4)①随着反应的进行盐酸的浓度逐渐减小,所以Zn与盐酸反应的速率逐渐减慢,故原因可能是盐酸浓度减小使反应速率减慢;
②金属与酸反应放热,温度升高反应速率加快,所以第4~6s的反应速率高于第2~4s的反应速率,原因可能是盐酸与Zn反应放热,使反应速率加快;
(5)依据上述实验及数据推测,温度越高,反应速率越快;氢离子浓度越大,反应速率越快;盐酸与硫酸氢离子浓度相同时,阴离子不同,反应速率不同,所以影响锌与酸反应生成氢气的快慢的因素有氢离子的浓度、温度以及Cl-、SO![]() 等。
等。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(2)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8min时,CO2的转化率是________。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。a、b、c、d四点中逆反应速率大小关系为_________,M、b、N三点中平衡常数K的大小关系是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式为:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2(g)=H2(l) △H=-0.92 kJ·mol-1
③O2(g)=O2(l) △H=-6.84 kJ·mol-1
④H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应H2(l)+![]() O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
A.△H=△H1+△H2+△H3+△H4
B.△H=△H1-△H2-△H3+△H4
C.△H=△H1+△H2+![]() △H3+△H4
△H3+△H4
D.△H=△H1-△H2-![]() △H3+△H4
△H3+△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 molL﹣1s﹣1B.v(B)=0.3molL﹣1s﹣1
C.v(C)=0.8 molL﹣1s﹣1D.v(D)=1 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究氨气的性质。

(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是__。
(2)①中湿润的红色石蕊试纸变为__色。
(3)向②中滴入浓盐酸,现象是___。
(4)甲、乙、丙三位同学设计的制取氨气的装置,

采用上述装置,用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为哪位同学能够达到实验目的__(填“甲”、“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为__(填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜制碱法生产流程为:
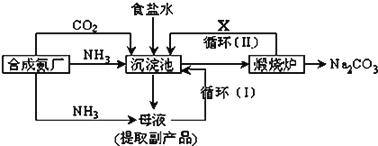
![]() 沉淀池中反应的化学方程式:________________________________;
沉淀池中反应的化学方程式:________________________________;
![]() 检验产品碳酸钠中是否含有氯化钠的操作方法为:___________________________
检验产品碳酸钠中是否含有氯化钠的操作方法为:___________________________
![]() 上述流程中物质X的分子式为 ______
上述流程中物质X的分子式为 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
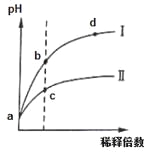
A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同
C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同
D.c点溶液的导电能力一定比b点溶液导电能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
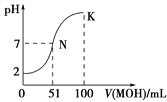
A. MOH为一元强碱
B. K点对应的溶液中:c(M+) + c(MOH) = c(A-)
C. K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol·L-1
D. N点水的电离程度小于K点水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )

A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com