
【题目】某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
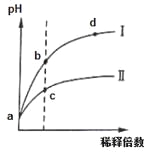
A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同
C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同
D.c点溶液的导电能力一定比b点溶液导电能力强
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

已知:①酯能被LiAlH4还原为醇
②![]() +2ROH
+2ROH![]() ROOC—COOR+H2O
ROOC—COOR+H2O
③HOC—CHO![]()
![]()
回答下列问题:
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
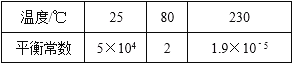
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外活动小组的同学探究影响锌与酸反应生成氢气的快慢的因素,实验如下:分别向两只烧杯中加入500mL0.4mol·L-1盐酸、500mLamol·L-1硫酸,再同时向两只烧杯中加入等质量、等大小的过量锌片(未用砂纸打磨),并开始记录数据。

(1)实验中硫酸的物质的量浓度的数值a为___。
(2)在2~6s内,Zn与盐酸的反应速率为v(H+)=__mol·L-1·s-1。
(3)在0~2s内,两溶液中的H+的物质的量浓度均下降至0.38mol·L-1,但均未得到H2,可能的原因是___。
(4)小组同学经过计算得到Zn与盐酸反应的速率随时间变化的情况。
①反应开始8s后,Zn与盐酸反应的速率逐渐减慢,原因可能是___。
②第4~6s的反应速率高于第2~4s的反应速率,原因可能是__。
(5)依据上述实验及数据推测,影响锌与酸反应生成氢气的快慢的因素有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:
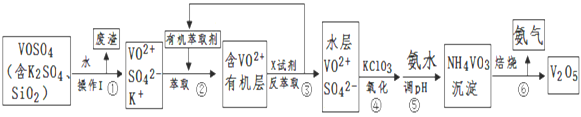
(1)步骤①所得废渣的成分是____________(写化学式),操作I的名称__________;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________;
③中X试剂为(写化学式)______________________________________;
(3)④的离子方程式为 ___________________________________________;
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________和_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.100 mol/L NaOH溶液滴定20.00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )
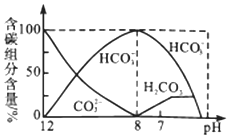
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示:下列说法正确的是( )
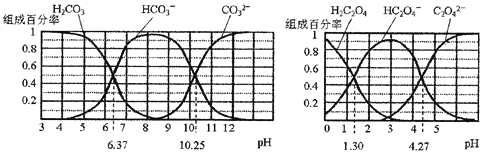
A.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应 HCO3-+H2O![]() H2CO3+OH-的平衡常数为
H2CO3+OH-的平衡常数为![]()
C.0.1 mol/L NaHC2O4溶液中c(C2O4-)+c(H2C2O4)=0.1 mol/L
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+ HC2O4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某碳酸溶液中的H2CO3、HCO3-、CO32-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )
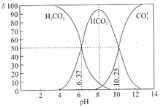
A.当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B.Ka2(H2CO3)的数量级为10-11
C.调节溶液的pH由8~10的过程中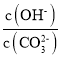 减小
减小
D.加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com