
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
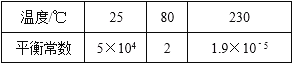
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
【答案】D
【解析】
A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度,平衡向吸热反应移动,故正反应为放热反应,故不选A;
B.25℃时反应Ni(s)+4CO(g)Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为![]() =2×10-5,故不选B;
=2×10-5,故不选B;
C.80℃达到平衡时,测得n(CO)=0.3mol,c(CO)=![]() =1mol/L,故c[Ni(CO)4]=
=1mol/L,故c[Ni(CO)4]=![]() =
=![]() =2mol/L,故不选C;
=2mol/L,故不选C;
D.浓度商Qc=![]() ==8,大于80℃平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故选D;
==8,大于80℃平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故选D;
答案:D。


科目:高中化学 来源: 题型:
【题目】在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )
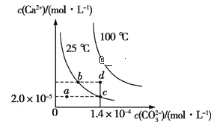
A.CaCO3(s)![]() Ca2+(aq)+CO32-(aq) ΔH<0
Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO47H2O)的流程如下:

已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________;滤渣Ⅱ经灼烧后可用于_______(写出一种用途即可)。
(2)“还原”的目的是__________,写出“还原”步骤中涉及反应的离子方程式_________。
(3)“除铝”反应过程中控制的pH范围是_______________________。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________,“洗涤”时的试剂最好选用下列中的____________(填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式为:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2(g)=H2(l) △H=-0.92 kJ·mol-1
③O2(g)=O2(l) △H=-6.84 kJ·mol-1
④H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应H2(l)+![]() O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
A.△H=△H1+△H2+△H3+△H4
B.△H=△H1-△H2-△H3+△H4
C.△H=△H1+△H2+![]() △H3+△H4
△H3+△H4
D.△H=△H1-△H2-![]() △H3+△H4
△H3+△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
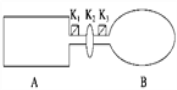
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 molL﹣1s﹣1B.v(B)=0.3molL﹣1s﹣1
C.v(C)=0.8 molL﹣1s﹣1D.v(D)=1 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究氨气的性质。

(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是__。
(2)①中湿润的红色石蕊试纸变为__色。
(3)向②中滴入浓盐酸,现象是___。
(4)甲、乙、丙三位同学设计的制取氨气的装置,

采用上述装置,用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为哪位同学能够达到实验目的__(填“甲”、“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为__(填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是

A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同
C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同
D.c点溶液的导电能力一定比b点溶液导电能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是
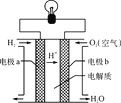
A.该电池中电极a是正极,发生还原反应
B.外电路中电子由电极a通过导线流向电极b
C.该电池的总反应为2H2O=2H2+O2
D.该电池工作时将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com