
【题目】由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO47H2O)的流程如下:

已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________;滤渣Ⅱ经灼烧后可用于_______(写出一种用途即可)。
(2)“还原”的目的是__________,写出“还原”步骤中涉及反应的离子方程式_________。
(3)“除铝”反应过程中控制的pH范围是_______________________。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________,“洗涤”时的试剂最好选用下列中的____________(填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________。
【答案】![]() 冶炼制取铝(或作耐火材料等) 将Fe3+还原为Fe2+后,便于分离铁元素和铝元素 FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ 大于或等于5.0,且小于6.3(或5.0≤pH<6.3) 蒸发浓缩、冷却结晶、过滤 C 取少量样品加水溶解配成溶液,滴加KSCN溶液,若溶液不变红色,说明无Fe3+;若溶液呈红色,说明其中含有Fe3+
冶炼制取铝(或作耐火材料等) 将Fe3+还原为Fe2+后,便于分离铁元素和铝元素 FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ 大于或等于5.0,且小于6.3(或5.0≤pH<6.3) 蒸发浓缩、冷却结晶、过滤 C 取少量样品加水溶解配成溶液,滴加KSCN溶液,若溶液不变红色,说明无Fe3+;若溶液呈红色,说明其中含有Fe3+
【解析】
硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3)中加入稀硫酸,得到:Fe2+、Fe3+、Al3+的酸性溶液,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,在滤液中加入FeS2,将Fe3+还原为Fe2+,反应为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,滤液为硫酸亚铁溶液,用稀硫酸酸化硫酸亚铁溶液后,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO47H2O,以此解答该题。
(1)分析知滤渣Ⅰ为SiO2,是酸性氧化物,但能溶于HF生成SiF4,气态产物SiF4是共价化合物,其电子式为![]() ;滤渣Ⅱ为Al(OH)3,受热分解的产物为Al2O3,因其高熔点,作耐火材料,也可通过电解冶炼得到Al;
;滤渣Ⅱ为Al(OH)3,受热分解的产物为Al2O3,因其高熔点,作耐火材料,也可通过电解冶炼得到Al;
(2) 利用FeS2可将Fe3+还原为Fe2+,同时生成SO42-,结合守恒法可知发生反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)“除铝”的目的是使溶液中Al3+完全沉淀,而溶液中的Fe2+不沉淀,则结合金属离子生成氢氧化物沉淀的pH范围表中数据,可知控制的pH范围是5.0≤pH<6.3;
(4)从硫酸亚铁溶液中获取绿矾晶体,需要经过蒸发浓缩、冷却结晶、过滤3个基本操作,其中“洗涤”时为减小绿矾晶体的溶解不使用热水,而选择乙醇,另外氯水能氧化Fe2+,也不宜用来洗涤绿矾,而饱和食盐水洗涤时绿矾表面会附杂质离子,而不纯,故只能选择乙醇洗涤,答案为C;
(5)利用含有Fe3+的溶液中滴加KSCN溶液会变红色,则检验制得的绿矾晶体中是否含有Fe3+的操作方法是将绿矾样品溶于水,取少量于试管中,滴加KSCN溶液,若溶液变成红色,说明含Fe3+,若溶液不变色,则不含Fe3+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
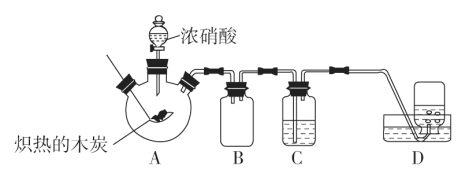
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中产生的气体颜色为__,产生该现象的化学方程式是__。
(2)装置C中盛有足量澄清石灰水,炽热的木炭与浓硝酸反应后可观察到C中的现象是__。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是__。
A.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
B.敞口观察装置D中集气瓶内气体的颜色变化
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH___填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
④(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
(2)常温下,若在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

已知:①酯能被LiAlH4还原为醇
②![]() +2ROH
+2ROH![]() ROOC—COOR+H2O
ROOC—COOR+H2O
③HOC—CHO![]()
![]()
回答下列问题:
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | C.反应不十分强烈,产生的气体可以在空气中燃烧 |
④镁带与2mol·L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
⑤铝条与2mol·L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________________________。
(2)实验用品:仪器___________________等;药品________________________等。
(3)实验内容:(*填写题给信息表中的序号)
实验方案* | 实验现象* | 有关化学方程式 |
_______________________________
(4)实验结论:______________________________________。
(5)请从结构理论上简单说明具有上述结论的原因___________________。
(6)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46kJ的热量,表示该反应的中和热的热化学方程式为
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46 kJ·mol-1
C.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
D.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×103Pa、298K条件下,4g氢气燃烧生成水蒸汽放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+![]() O2(g) △H=+242 kJ·mol-1
O2(g) △H=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(l) △H=-242 kJ·mol-1
O2(g)= H2O(l) △H=-242 kJ·mol-1
D.H2O(l)=2H2(g)+O2(g) △H=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
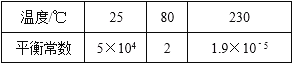
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )
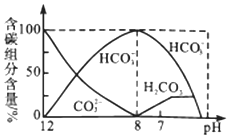
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com