
【题目】(1)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(2)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8min时,CO2的转化率是________。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。a、b、c、d四点中逆反应速率大小关系为_________,M、b、N三点中平衡常数K的大小关系是_______。
【答案】0.015 小于 33.3% d>c>b>a K(b)=K(M)>K(N)
【解析】
(1)根据v=![]() 计算v(NO);由表中数据可知,2min平衡时活性炭变化量为2.03mol-2mol=0.03mol,平均1min消耗0.015molC(s),但第一分钟反应速率较第二分钟快,故消耗0.015molC(s)时需要的时间小于1min;
计算v(NO);由表中数据可知,2min平衡时活性炭变化量为2.03mol-2mol=0.03mol,平均1min消耗0.015molC(s),但第一分钟反应速率较第二分钟快,故消耗0.015molC(s)时需要的时间小于1min;
(2)①反应在0~8min时,H2的变化物质的量为8mol-2mol=6mol,由CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)可知,CO2变化物质的量为6mol×
CH3OH(g)+H2O(g)可知,CO2变化物质的量为6mol×![]() =2mol,则CO2的转化率=
=2mol,则CO2的转化率=![]() ;
;
②a、b、c、d均是在相同温度下进行的,随着反应的进行,生成物的浓度越来越大,则逆反应速率越来越快;根据图知,改变条件I时,反应达到平衡时间缩短,说明化学反应速率加快,但是氢气转化率减小且初始氢气物质的量不变,平衡逆向移动;改变条件II时,反应达到平衡时间缩短,说明化学反应速率加快,但是氢气转化率增大且初始氢气物质的量不变,平衡正向移动;化学平衡常数只与温度有关,该反应是放热反应,升高温度平衡常数减小。
(1)由表中数据可知,2min平衡时NO变化量为0.1mol-0.04mol=0.06mol,故v(NO)= =0.015mol/(Lmin);由表中数据可知,2min平衡时活性炭变化量为2.03mol-2mol=0.03mol,平均1min消耗0.015molC(s),但第一分钟反应速率较第二分钟快,故消耗0.015molC(s)时需要的时间小于1min;
=0.015mol/(Lmin);由表中数据可知,2min平衡时活性炭变化量为2.03mol-2mol=0.03mol,平均1min消耗0.015molC(s),但第一分钟反应速率较第二分钟快,故消耗0.015molC(s)时需要的时间小于1min;
(2)①反应在0~8min时,H2的变化物质的量为8mol-2mol=6mol,由CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)可知,CO2变化物质的量为6mol×
CH3OH(g)+H2O(g)可知,CO2变化物质的量为6mol×![]() =2mol,则CO2的转化率=
=2mol,则CO2的转化率=![]() =
=![]() =33.3%;
=33.3%;
②a、b、c、d均是在相同温度下进行的,随着反应的进行,生成物的浓度越来越大,则逆反应速率越来越快,则a、b、c、d四点中逆反应速率大小关系为d>c>b>a;根据图知,改变条件I时,反应达到平衡时间缩短,说明化学反应速率加快,但是氢气转化率减小且初始氢气物质的量不变,平衡逆向移动,改变的体积是升高温度;改变条件II时,反应达到平衡时间缩短,说明化学反应速率加快,但是氢气转化率增大且初始氢气物质的量不变,平衡正向移动,改变的条件是增大压强,该反应是放热反应,升高温度化学平衡常数减小,温度不变化学平衡常数不变,则I高于原来温度、II和原来温度相同,则M、b、N三点中平衡常数K的大小关系是K(b)=K(M)>K(N)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )

A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向![]() 溶液中加入
溶液中加入![]() 固体,则溶液中
固体,则溶液中![]() ________(填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间关系的一个等式:_______________________________________________________________。
________(填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间关系的一个等式:_______________________________________________________________。
(2)土壤的pH一般在4~9之间。土壤中N![]() 含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________________________________________________。
含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________________________________________________。
加入石膏![]() 可以使土壤碱性降低,有关反应的化学方程式为____________。
可以使土壤碱性降低,有关反应的化学方程式为____________。
(3)常温下在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液40 mL,溶液中含碳元素的各种粒子(
溶液40 mL,溶液中含碳元素的各种粒子(![]() 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
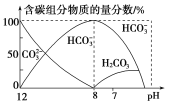
回答下列问题:
①在同一溶液中,![]() 、
、![]() 、
、![]() ________(填“能”或“不能”)大量共存;
________(填“能”或“不能”)大量共存;
②当![]() 时,溶液中含碳元素的主要粒子为________,溶液中各种离子的物质的量浓度的大小关系为_____________________________________________________________________________________;
时,溶液中含碳元素的主要粒子为________,溶液中各种离子的物质的量浓度的大小关系为_____________________________________________________________________________________;
③已知在25 ℃时,![]() 水解反应的平衡常数即水解常数
水解反应的平衡常数即水解常数![]()
![]() ,当溶液中
,当溶液中![]() 时,溶液的
时,溶液的![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH___填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
④(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
(2)常温下,若在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )

A.反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4转移12 mol电子
3H2+CO,每消耗1 mol CH4转移12 mol电子
B.电极A上H2参与的电极反应为H2+2OH--2e-===2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

已知:①酯能被LiAlH4还原为醇
②![]() +2ROH
+2ROH![]() ROOC—COOR+H2O
ROOC—COOR+H2O
③HOC—CHO![]()
![]()
回答下列问题:
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46kJ的热量,表示该反应的中和热的热化学方程式为
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46 kJ·mol-1
C.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
D.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外活动小组的同学探究影响锌与酸反应生成氢气的快慢的因素,实验如下:分别向两只烧杯中加入500mL0.4mol·L-1盐酸、500mLamol·L-1硫酸,再同时向两只烧杯中加入等质量、等大小的过量锌片(未用砂纸打磨),并开始记录数据。

(1)实验中硫酸的物质的量浓度的数值a为___。
(2)在2~6s内,Zn与盐酸的反应速率为v(H+)=__mol·L-1·s-1。
(3)在0~2s内,两溶液中的H+的物质的量浓度均下降至0.38mol·L-1,但均未得到H2,可能的原因是___。
(4)小组同学经过计算得到Zn与盐酸反应的速率随时间变化的情况。
①反应开始8s后,Zn与盐酸反应的速率逐渐减慢,原因可能是___。
②第4~6s的反应速率高于第2~4s的反应速率,原因可能是__。
(5)依据上述实验及数据推测,影响锌与酸反应生成氢气的快慢的因素有__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com