
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向![]() 溶液中加入
溶液中加入![]() 固体,则溶液中
固体,则溶液中![]() ________(填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间关系的一个等式:_______________________________________________________________。
________(填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间关系的一个等式:_______________________________________________________________。
(2)土壤的pH一般在4~9之间。土壤中N![]() 含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________________________________________________。
含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________________________________________________。
加入石膏![]() 可以使土壤碱性降低,有关反应的化学方程式为____________。
可以使土壤碱性降低,有关反应的化学方程式为____________。
(3)常温下在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液40 mL,溶液中含碳元素的各种粒子(
溶液40 mL,溶液中含碳元素的各种粒子(![]() 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
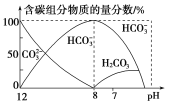
回答下列问题:
①在同一溶液中,![]() 、
、![]() 、
、![]() ________(填“能”或“不能”)大量共存;
________(填“能”或“不能”)大量共存;
②当![]() 时,溶液中含碳元素的主要粒子为________,溶液中各种离子的物质的量浓度的大小关系为_____________________________________________________________________________________;
时,溶液中含碳元素的主要粒子为________,溶液中各种离子的物质的量浓度的大小关系为_____________________________________________________________________________________;
③已知在25 ℃时,![]() 水解反应的平衡常数即水解常数
水解反应的平衡常数即水解常数![]()
![]() ,当溶液中
,当溶液中![]() 时,溶液的
时,溶液的![]() ________。
________。
【答案】不变 ![]()
![]()
![]() 不能
不能 ![]() 、
、![]()
![]() 10
10
【解析】
(1)醋酸的电离常数K仅受温度影响,温度不变电离常数不变;混合溶液中存在电荷守恒;
(2)土壤呈碱性的原因是![]() 在溶液中水解使溶液呈碱性所致,加入石膏,
在溶液中水解使溶液呈碱性所致,加入石膏,![]() 与碳酸钠溶液反应生成更难溶的物质CaCO3;
与碳酸钠溶液反应生成更难溶的物质CaCO3;
(3)①![]() 与
与![]() 反应生成
反应生成![]() ;
;
②由图可知![]() 时,含碳粒子为
时,含碳粒子为![]() 、
、![]() ,各种离子的浓度大小关系为
,各种离子的浓度大小关系为![]()
![]() ;
;
③由水解常数公式计算溶液中![]() 时的pH。
时的pH。
(1)醋酸的电离常数![]() ,K仅受温度影响,温度不变电离常数不变;混合溶液中存在电荷守恒和物料守恒,由电荷守恒得
,K仅受温度影响,温度不变电离常数不变;混合溶液中存在电荷守恒和物料守恒,由电荷守恒得![]()
![]() ,故答案为:不变;
,故答案为:不变;![]()
![]() ;
;
(2)土壤呈碱性的原因是![]() 在溶液中水解使溶液呈碱性所致,水解的离子方程式为
在溶液中水解使溶液呈碱性所致,水解的离子方程式为![]() ;利用沉淀的转化与生成规律可知,加入石膏,
;利用沉淀的转化与生成规律可知,加入石膏,![]() 与碳酸钠溶液反应生成更难溶的物质CaCO3,反应的化学方程式为
与碳酸钠溶液反应生成更难溶的物质CaCO3,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)①![]() 与
与![]() 反应生成
反应生成![]() ,故
,故![]() 、
、![]() 、
、![]() 不能大量共存,故答案为:不能;
不能大量共存,故答案为:不能;
②由图可知![]() 时,含碳粒子为
时,含碳粒子为![]() 、
、![]() ,各种离子的浓度大小关系为
,各种离子的浓度大小关系为![]()
![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;![]()
![]() ;
;
③由水解常数公式可知,当溶液中![]() 时,
时,![]() ,溶液中
,溶液中![]() ,则溶液的
,则溶液的![]() ,故答案为:10。
,故答案为:10。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:

(1)写出实验室制取氯气的离子方程式_____________,NA表示阿伏加德罗常数的值,若有3mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含4molHCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)1mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
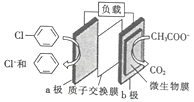
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值用NA表示。下列说法中不正确的是
A. 0.5 mol由F2与Ar组成的混合气体中含质子总数为9NA
B. 标准状况下,足量Na2O2与5.6 L CO2反应转移电子数目为0.25NA
C. 71g Cl2通入水中,HClO、ClO-、Cl-三种微粒数目之和为2NA
D. 常温下,1.5 L 1.0 mol L-1 CuSO4溶液中阳离子数目大于1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”很好地诠释了我国当前对环境保护的认识。某微生物燃料电池可很好的解决当前河流中的有机废水问题。某污染的河水中含有大量的葡萄糖,通过下面的微生物电池进行处理可达到净水的初级目标。下列有关说法错误的是( )
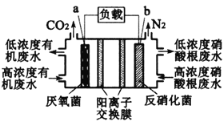
A.a极是负极
B.b极的电极反应式为:2NO3-+6H2O+10e-=N2+12OH-
C.右室溶液中的氢氧根可以进入左室,使左室溶液的pH增大
D.电池工作时,外电路中流过2.4mol电子时,产生标准状况下13.44LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )
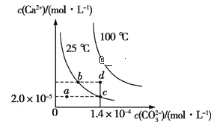
A.CaCO3(s)![]() Ca2+(aq)+CO32-(aq) ΔH<0
Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(2)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8min时,CO2的转化率是________。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。a、b、c、d四点中逆反应速率大小关系为_________,M、b、N三点中平衡常数K的大小关系是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式为:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2(g)=H2(l) △H=-0.92 kJ·mol-1
③O2(g)=O2(l) △H=-6.84 kJ·mol-1
④H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应H2(l)+![]() O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
A.△H=△H1+△H2+△H3+△H4
B.△H=△H1-△H2-△H3+△H4
C.△H=△H1+△H2+![]() △H3+△H4
△H3+△H4
D.△H=△H1-△H2-![]() △H3+△H4
△H3+△H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com