
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:

(1)写出实验室制取氯气的离子方程式_____________,NA表示阿伏加德罗常数的值,若有3mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含4molHCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)1mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是_______。
【答案】MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 3NA < B 除去Cl2中的HCl
Mn2++2H2O+Cl2↑ 3NA < B 除去Cl2中的HCl
【解析】
实验室中一般利用浓盐酸和二氧化锰共热制取氯气,生成的氯气中混有HCl气体,可以用饱和食盐水除去,之后再用浓硫酸进行干燥,氯气的密度比空气大,可以用向上排空气法收集,氯气会污染空气,所以多余的氯气要进行处理。
(1)浓盐酸和二氧化锰共热制取氯气,离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;HCl被氧化生成Cl2,化合价升高1价,所以3molHCl被氧化转移的电子总数为3NA;由于浓盐酸在反应过程中会变稀,而稀盐酸与二氧化锰不反应,所以生成的氯气小于1mol;
Mn2++2H2O+Cl2↑;HCl被氧化生成Cl2,化合价升高1价,所以3molHCl被氧化转移的电子总数为3NA;由于浓盐酸在反应过程中会变稀,而稀盐酸与二氧化锰不反应,所以生成的氯气小于1mol;
(2)根据分析可知Y选用浓硫酸,即B;X选用饱和食盐水,除去Cl2中的HCl。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】(实验班)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)![]() Sr2+(aq)+SO
Sr2+(aq)+SO![]() (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s)![]() Sr2+(aq)+CO
Sr2+(aq)+CO![]() (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________________,该反应的平衡常数为__________________(填具体数字);该反应能发生的原因是
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO![]() 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;②增大CO![]() 的浓度,平衡常数K将________。
的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
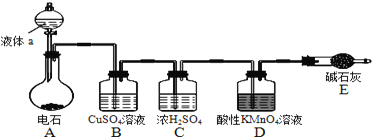
(1)写出实验室制取乙炔的化学方程式:______ .
(2)实验室制取乙炔时,分液漏斗中的液体a通常是______ .
(3)![]() 溶液的作用是______ .
溶液的作用是______ .
(4)装置D中的现象是:______ .
(5)工业上常用乙炔、二氧化锰和浓盐酸等物质作原料来合成聚氯乙烯,请写出相关方程式:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )

A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
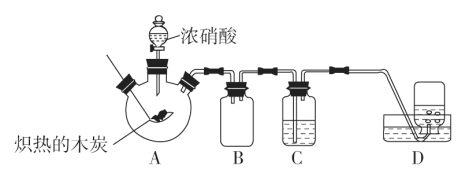
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中产生的气体颜色为__,产生该现象的化学方程式是__。
(2)装置C中盛有足量澄清石灰水,炽热的木炭与浓硝酸反应后可观察到C中的现象是__。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是__。
A.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
B.敞口观察装置D中集气瓶内气体的颜色变化
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向![]() 溶液中加入
溶液中加入![]() 固体,则溶液中
固体,则溶液中![]() ________(填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间关系的一个等式:_______________________________________________________________。
________(填“增大”“不变”或“减小”);写出表示该混合溶液中所有离子浓度之间关系的一个等式:_______________________________________________________________。
(2)土壤的pH一般在4~9之间。土壤中N![]() 含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________________________________________________。
含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________________________________________________。
加入石膏![]() 可以使土壤碱性降低,有关反应的化学方程式为____________。
可以使土壤碱性降低,有关反应的化学方程式为____________。
(3)常温下在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液40 mL,溶液中含碳元素的各种粒子(
溶液40 mL,溶液中含碳元素的各种粒子(![]() 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
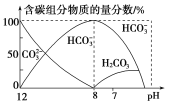
回答下列问题:
①在同一溶液中,![]() 、
、![]() 、
、![]() ________(填“能”或“不能”)大量共存;
________(填“能”或“不能”)大量共存;
②当![]() 时,溶液中含碳元素的主要粒子为________,溶液中各种离子的物质的量浓度的大小关系为_____________________________________________________________________________________;
时,溶液中含碳元素的主要粒子为________,溶液中各种离子的物质的量浓度的大小关系为_____________________________________________________________________________________;
③已知在25 ℃时,![]() 水解反应的平衡常数即水解常数
水解反应的平衡常数即水解常数![]()
![]() ,当溶液中
,当溶液中![]() 时,溶液的
时,溶液的![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

已知:①酯能被LiAlH4还原为醇
②![]() +2ROH
+2ROH![]() ROOC—COOR+H2O
ROOC—COOR+H2O
③HOC—CHO![]()
![]()
回答下列问题:
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com