
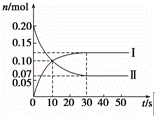
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2⇌2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
①图象中曲线 Ⅰ (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是 放 热反应(选填“吸”或“放”).
③在800℃时,若缩小容器的体积,达新平衡时n(NO) < (选填“>”、“=”或“<”)0.07mol,NO的转化率 增大 (选填“增大”、“不变”或“减小”).
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)⇌SiO2(s)
+4HF(g)△H=+148.9kJ•mol﹣1.
①下列各项中能说明该反应已达化学平衡状态的是 bcd (填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.通过a或b的值及化学平衡原理判断t1时反应是否达到化学平衡状态: t1时反应已经达到化学平衡状态 .
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
| 物质的量或浓度随时间的变化曲线;化学平衡的影响因素;化学平衡状态的判断.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)①曲线Ⅱ表示的物质的量减小是反应物,曲线Ⅰ表示的物质的量增大是生成物; ②根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,依此判断平衡移动和反应热; ③缩小容器体积,压强增大,据此判断平衡移动; (2)①根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,注意选择的物理量应随反应进行发生变化,该物理量由变化到不变,说明到达平衡; ②依据化学平衡三段式列式计算,结合热化学方程式分析判断. |
| 解答: | 解:(1)①曲线Ⅱ表示的物质的量减小是反应物,曲线Ⅰ表示的物质的量增大是生成物,所以曲线Ⅰ表示NO2的变化,故答案为:Ⅰ; ②根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,与图中的平衡比较,NO物质的量增加了,所以升高温度平衡向逆反应方向移动,故正反应为放热反应,故答案为:放; ③缩小容器体积,压强增大,平衡向正反应方向移动,所以NO的物质的量减少,即达新平衡时n(NO)<0.07mol;平衡向正反应方向移动,则NO转化率增大, 故答案为:<;增大; (2)①a、υ消耗(SiF4)=υ生成(HF),都表示正反应速率,且比例关系不等于化学计量数之比,不能说明到达平衡状态,故错误; b、正反应是气体物质的量增大的反应,随反应进行容器内压强增大,容器内气体压强不再变化说明到达平衡状态,故正确; c、反应有固体生成,随反应进行气体的总质量减小,容器内气体的总质量不再变化,说明到达平衡状态,故正确; d、平衡时,各组分的含量不变,HF体积分数不再变化,说明到达平衡状态,故正确; 故答案为:bcd; ②由表中数据可知,t1时△n(SiF4)=1.2mol﹣0.8mol=0.4mol,根据方程式可知△n(H2O)=2△n(SiF4)=0.8mol,故t1时刻,水的物质的量=2.4mol﹣0.8mol=1.6mol,说明在一定条件下,t1~t2时各组分的浓度(或物质的量)均已不再发生改变,所以t1时反应已经达到化学平衡状态. 故答案为:t1时反应已经达到化学平衡状态. |
| 点评: | 本题考查了反应速率和化学平衡的有关知识,注意理解化学平衡状态的判断,侧重于基本原理的应用,题目难度中等. |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
(1)约含有6.02×1023个H2O分子的H2O中质子的物质的量 ;
(2)约含有6.02×1023个Fe3+的Fe2(SO4)3 中SO42-的物质的量 ;
(3)约含有6.02×1023个e-的NH3的物质的量 ;
(4)2 mol OH-约含有 个电子
(5)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是 ;
A的相对原子质量是 ;
(6) xAm+与bBn-核外电子排布相同,则x= ;
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ/mol
根据上述反应,下列说法正确的是( )
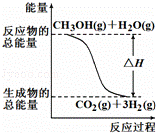
|
| A. | 反应①中的能量变化如图所示 |
|
| B. | CH3OH转变成H2的过程一定要吸收能量 |
|
| C. | 1mol CH3OH充分燃烧放出的热量为192.9kJ |
|
| D. | 可推知2H2(g)+O2(g)═2H2O(g)△H=﹣483.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol﹣1
②N2(g)+3H2(g)⇌2NH3(g)△H2=﹣92.4kJ•mol﹣1
③2H2(g)+O2(g)═2H2O(g)△H3=﹣483.6kJ•mol﹣1
下列说法正确的是( )
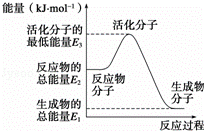
|
| A. | 反应②中的能量变化如图所示,则△H2=E1﹣E3 |
|
| B. | H2的燃烧热为241.8 kJ•mol﹣1 |
|
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
|
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(严禁振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是
| 甲 | 乙 | 丙 | |
| A | 1,2—二溴乙烷 | 水 | 苯 |
| B | 溴苯 | 液溴 | 乙醇 |
| C | 水 | 大豆油 | 溴水 |
| D | 乙醇 | 乙酸 | 乙酸乙酯 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com