
(1)约含有6.02×1023个H2O分子的H2O中质子的物质的量 ;
(2)约含有6.02×1023个Fe3+的Fe2(SO4)3 中SO42-的物质的量 ;
(3)约含有6.02×1023个e-的NH3的物质的量 ;
(4)2 mol OH-约含有 个电子
(5)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是 ;
A的相对原子质量是 ;
(6) xAm+与bBn-核外电子排布相同,则x= ;
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系正确的是 ( )
A.室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+)
B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+) >c(Cl-) >c(HCO3-) >c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = c(Ba2+)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-) + c(A-) = 2c(H+) + c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
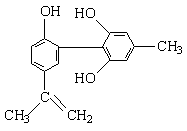 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下所示,有关该物质的说法正确的是
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下所示,有关该物质的说法正确的是
① 该物质属于芳香族化合物高考资源网
② 该有机物的分子式为C15H18O3
③ 该物质所有的碳原子一定在同一个平面上
④ 遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物
⑤ 1mol该化合物最多可与3mol NaOH发生反应
⑥ 1mol该化合物最多可与含3molBr2的溴水发生取代反应
A.①⑤⑥ B.①④⑤ C.①④⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是 ( )
A.NaHCO3=Na++H++CO32- B.NaHSO4=Na++H++SO42-
C.H2SO4=2H++SO4- D.KClO3=K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是对硝酸型酸雨的若干项评价,其中正确的是 ( )
①杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
②对电线、铁轨、桥梁、房屋等均会造成损害
③导致臭氧层空洞
④硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
⑤酸雨的PH小于5.6
A.①②④⑤ B.②④ C.③④⑤ D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)人们常用空气污染指数API来表示空气的质量。空气污染指数是根据空气中 、
和 等污染物的浓度计算出来的数值。
(2)污水的处理方法主要有 、 和生物方法。
(3)常见的染发剂有 、 和合成染发剂等三大类。
(4)食品添加剂种类繁多,性能各异,但主要有 、 、 、
和 等四种类型。
查看答案和解析>>
科目:高中化学 来源: 题型:
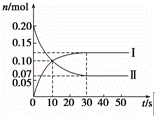
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2⇌2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
①图象中曲线 Ⅰ (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是 放 热反应(选填“吸”或“放”).
③在800℃时,若缩小容器的体积,达新平衡时n(NO) < (选填“>”、“=”或“<”)0.07mol,NO的转化率 增大 (选填“增大”、“不变”或“减小”).
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)⇌SiO2(s)
+4HF(g)△H=+148.9kJ•mol﹣1.
①下列各项中能说明该反应已达化学平衡状态的是 bcd (填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.通过a或b的值及化学平衡原理判断t1时反应是否达到化学平衡状态: t1时反应已经达到化学平衡状态 .
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com