
【题目】实验室检验SO2中混有CO2的装置如图所示。下列说法正确的是
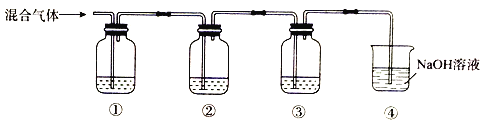
A. ①、②、③中可依次盛放饱和NaHCO3溶液、品红溶液、澄清石灰水
B. ②的主要作用是除去SO2
C. ③中观察到的现象是先有白色沉淀,当沉淀最多后再不断溶解
D. 该装置也可用于检验NO2中混有NO
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
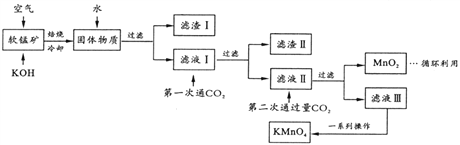
(1)配平焙烧时化学反应: □MnO2+□_____+□O2![]() □K2MnO4+□H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因__________。
□K2MnO4+□H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因__________。
(2)滤渣II 的成分有_______(化学式);第一次通CO2不能用稀盐酸代替的原因是_________。
(3)第二次通入过量CO2生成MnO2的离子方程式为_________。
(4)将滤液Ⅲ进行一系列操作得KMnO4。
由下图可知,从滤液Ⅲ得到KMnO4需经过_____、______、洗涤等操作。

(5)工业上按上述流程连续生产。含MnO2a%的软锰矿1吨,理论上最多可制KMnO4___吨。
(6)利用电解法可得到更纯的KMnO4。用惰性电极电解滤液II。
①电解槽阳极反应式为____________;
②阳极还可能有气体产生,该气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是( )
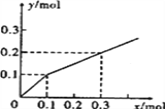
A. N3+>H+>M+
B. M+>N3+>H+
C. M+>H+>N3+
D. 条件不足,无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是
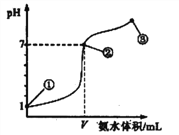
A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
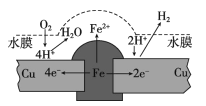
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒在工业生产中有重要用途。某含钒废料的成分为V2O5、V2O4、SiO2、Fe2O3、Al2O3,实验小组从其中回收V2O5的一种工艺流程如下:
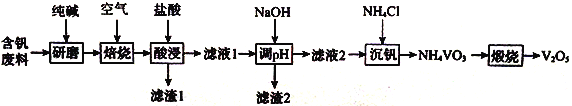
请回答下列问题;
(1)(研磨)的目的为__________________。所加纯碱不宜过量太多,理由为_________。
(2)“焙烧”后所得混合物中除含Na2CO3、NaVO3、Fe2O3、NaA1O2外,还含有________(填化学式)。
(3)“酸浸”时,VO3-转化为VO2+,转化反应的离子方程式为_________________________;滤渣1的主要成分为_________________(填化学式)。
(4)已知:常温下,Al(OH)3、Fe(OH)3 饱和溶液中金属阳离子浓度的负对数[-lg c(M3+ )]与pH 的关系如图所示:
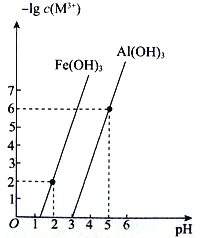
常温下,Ksp[Fe(OH)3]=________________________;当调pH=4 时,溶液中A13+________(填“是”或“否”)沉淀完全。(已知;溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全)
(5)“煅烧”时,反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
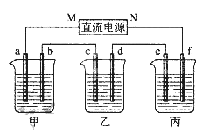
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为________极;
(2)电极b上发生的电极反应为:__________________,生成的气体在标准状况下的体积为__________L(保留两位有效数字);
(3)若要使乙溶液恢复到电解前的状态,可向乙溶液中加入________(填化学式),质量为________g(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的无色透明溶液中不能大量共存的离子组是( )
A.Al3+、Ag+、NO3、﹣Cl﹣
B.Mg2+、NH4+、NO3﹣、Cl﹣
C.Ba2+、K+、S2、﹣Cl﹣
D.Zn2+、Na+、NO3﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com