
【题目】碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
![]()
A. a的同分异构体有7种B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为![]() D. b、c互为同系物
D. b、c互为同系物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是________,判断理由是_________________________________。
(2)写出相应物质的化学式:A___________,C___________。
(3)写出实验②中有关反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时,将0.5 mol H2和1 mol CO2通入1L的恒容密闭容器中,反应生成甲醇蒸气(![]() )和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示。下列说法中不正确的是( )
)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示。下列说法中不正确的是( )
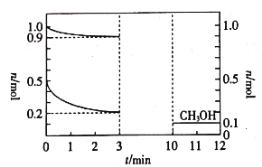
A.该反应的化学方程式:![]()
B.在0~3 min内,![]() 的平均反应速率为
的平均反应速率为![]()
C.在3~10 min内,反应仍未达到平衡状态
D.10 min时,再通入0.5 mol H2和1 mol CO2,可提高H2和CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用冶铅废渣(含Pb、PbO、PbS及Zn、Fe、Cu等杂质)制取立德粉和回收铅的工艺流程如下:
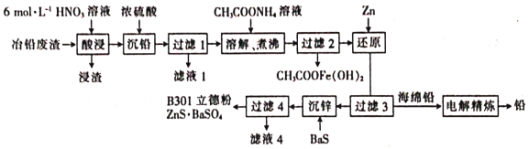
(1)“酸浸”时,PbS被氧化生成S,硝酸被还原为NO,则氧化0.3 mol PbS时,消耗HNO3______mol。
(2)“溶解、煮沸”时会发生多个反应。
①PbSO4溶解的离子方程式为__________________。(已知:Pb(CH3COO)2是弱电解质)
②“沉铅”时生成的沉淀中混有Fe3+,煮沸时醋酸铁水解的化学方程式为__________________。
(3)海绵铅(含少量Zn、Cu等杂质)进行“电解精炼”时,用PbSiF6、H2SiF6的混合溶液作电解液,海绵铅作_____(填“阳”或“阴”)极,阳极泥的主要成分是______(填化学式)。
(4)B301立德粉(ZnS·BaSO4)中ZnS的理论含量为29.4%。
①若要生产ZnS的理论含量为62.5%的B311高ZnS立德粉,可用的原料除BaS外,另两种原料可能为______。(填标号)
A. ZnSO4 B.NaCl C. ZnCl2 D. Na2SO4
②测定立德粉中ZnS的含量常用酸溶,调节pH至1~3,然后滴定形成K2Zn3[Fe(CN)6]2沉淀,该沉淀的溶度积常数Ksp的表达式为______。
(5)滤液4经加热后可返回______工序循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO![]()
![]() 2PbSO4+2H2O,下列说法错误的是( )
2PbSO4+2H2O,下列说法错误的是( )
A.充电时,阴极反应式为:SO![]() +4H++PbO2+2e﹣═PbSO4+2H2O
+4H++PbO2+2e﹣═PbSO4+2H2O
B.充电时,两个电极的质量均减轻
C.电池放电时,电解质溶液的pH增大
D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a制备,b会发生较多的副反应.回答下列问题:
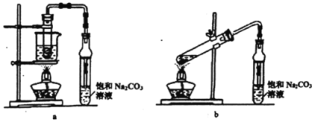
(1)实验时,通常加入过量的乙醇,原因是_____。
(2)饱和Na2CO3溶液的作用是_____。
(3)反应结束后,将盛有饱和Na2CO3溶液的试管中收集到的产品倒入分液漏斗中,_____、_____,然后分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步:
Ⅰ.葡萄糖酸(C6H12O7)的制备。量取50 mL蒸馏水于100 mL烧杯中,搅拌下缓慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂,交换液收集在烧杯中,得到无色的葡葡糖酸溶液。
Ⅱ.葡萄糖酸锌的制备。向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2g。
回答下列问题:
(1)制备葡萄糖酸的化学方程式为________________。
(2)通过强酸性阳离子交换树脂的目的是_______________。
(3)检验葡萄糖酸溶液中是否存在SO42-的操作为_________。
(4)制备葡萄糖酸时选用的最佳加热方式为_______________。
(5)制备葡萄糖酸锌时加入乙醇的目的是________,“一系列操作”具体是指_______。
(6)葡萄糖酸锌的产率为______(用百分数表示),若pH≈5时就进行后续操作,产率将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的说法不正确的是
A.过滤、萃取、结晶都是依据物质溶解度差异进行的分离提纯
B.可用冷却热饱和溶液的方法除去NaCl中混有的少量KNO3
C.取少量火柴头浸泡液加入硝酸银、稀硝酸和NaNO2,若出现白色沉淀,说明火柴头含氯元素
D.检验海带中碘元素的方法:灼烧→溶解→过滤→氧化→检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com