
【题目】已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是________,判断理由是_________________________________。
(2)写出相应物质的化学式:A___________,C___________。
(3)写出实验②中有关反应的离子方程式___________________________________。
【答案】(NH4)2CO3 D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,D只能为(NH4)2CO3 H2SO4 Ba(NO3)2 ![]() 、NH3+H+=NH4+
、NH3+H+=NH4+
【解析】
(1)D和B反应能生成气体,D和A也能生成气体,给出的8种离子能生成气体的是2H++CO32-=CO2↑+H2O和OH-+NH4+=NH3↑+H2O,所以D中既有CO32-;又有NH4+,所以D是(NH4)2CO3。故答案为:(NH4)2CO3 ,D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,D只能为(NH4)2CO3 。
(2)D和B生成的气体能被A吸收,D和A生成的气体能被B吸收,说明A和B一种是酸,一种是碱。根据①在A或D中滴入C,都有沉淀生成,根据给出的8种离子,应该是Ba2+滴入含硫酸根离子和碳酸根离子的溶液中,生成硫酸钡和碳酸钡沉淀。而碳酸根离子在D中,所以硫酸根离子在A中,所以A就是硫酸,那么B就是碱。B的阳离子只能是Na+,所以B只能是氢氧化钠,C就是硝酸钡。故答案为:H2SO4 ,Ba(NO3)2;
(3)(NH4)2CO3和NaOH反应生成NH3,NH3被H2SO4吸收,反应的离子方程式为:![]() 、NH3+H+=NH4+。
、NH3+H+=NH4+。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
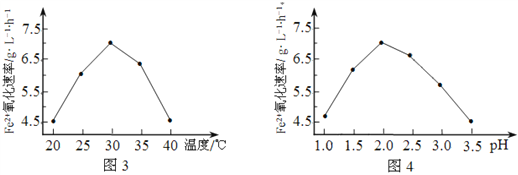
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质的实验装置,反应原理为CH3CH2OH![]() CH2=CH2↑+H2O,回答下列问题:
CH2=CH2↑+H2O,回答下列问题:

(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是______________。
(3)向溴的四氯化碳溶液中通入乙烯(如图),溶液的颜色很快褪去,该反应属于_______(填反应类型),反应的化学方程式为______________。

Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。
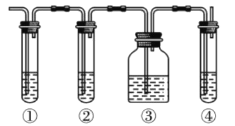
试回答下列问题:
(1)图中①、②、③、④装置盛放的试剂是下列中的(将正确选项填入空格内):
①_______;②_______;③_______;④_______。
A.氢氧化钠溶液 B.浓硫酸溶液 C.酸性高锰酸钾溶液 D.品红溶液
(2)能说明二氧化硫气体存在的现象是__________。
(3)使用装置②的目的是___________。
(4)使用装置③的目的是___________。
(5)确认含有乙烯的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.硝酸银溶液与盐酸反应:Ag++HCl=AgCl↓+H+
B.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.铜与浓硝酸反应:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[![]() ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,![]() 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是
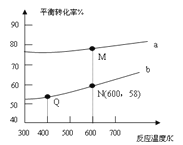
A.曲线b所对应的投料比为3:1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
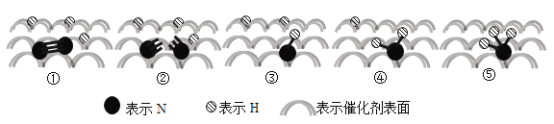
N2(g)+3H2(g)![]() 2NH3(g) △H = 92 kJ/mol
2NH3(g) △H = 92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率
B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂
D.反应过程中存在NH、NH2等中间产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法正确的是( )
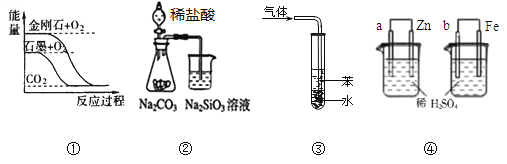
A.图①表示石墨转变为金刚石是吸热反应
B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅
C.图③吸收NH3并防倒吸
D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:i.RCH2Br![]()
![]()
ii.![]()
![]()
iii.![]()
 (以上R,
(以上R,![]() ,
,![]() 代表氢,烷基或芳基等)
代表氢,烷基或芳基等)
(1)A属于芳香烃,其名称是___________。
(2)B的结构简式是___________。
(3)C生成D的化学方程式是___________
(4)由G生成H的反应类型是___________,试剂b是___________。
(5)下列说法正确的是______(选填字母序号)。
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c.1molG最多可以与1molH2发生加成反应
d.1molF或1molH与足量NaOH溶液反应,均消耗2 mol NaOH
(6)E有多种同分异构体,其中属于芳香族化合物,并既能发生加聚反应又能发生水解反应的有_____种(不考虑立体异构)。
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
,写出合成路(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com