
【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D
【答案】A
【解析】
A.NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,与浓盐酸挥发出的HCl反应生成氯化铵固体,反应现象是产生白烟,A正确;
B.氨气为碱性气体,与浓硫酸发生中和反应生成硫酸铵,B错误;
C.氨气与氯化物在溶液中发生复分解反应生成氢氧化物,如使氯化物溶液变浑浊,可能生成难溶性氢氧化物,但不一定为Al(OH)3,也可能为Mg(OH)2等沉淀,C错误;
D.氨气使湿润的红色石蕊试纸变蓝的原因是与水反应生成NH3H2O,NH3H2O电离生成OH-离子使溶液呈碱性,但OH-不是NH3电离产生,因此氨气为非电解质,不属于碱,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
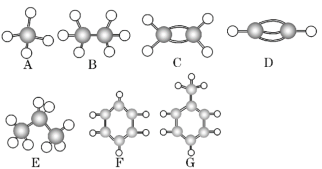
(1)常温下含氢量最高的气态烃是________(填字母)。
(2)能够使酸性高锰酸钾溶液褪色的烃有________种。
(3)写出F发生硝化反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
B.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.氯化铝溶液与氨水反应:Al3++4OH-=AlO![]() +2H2O
+2H2O
D.碳酸钠溶液与稀盐酸的反应:Na2CO3+2H+=CO2↑+H2O+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如图反应得到,则丙的结构不可能是
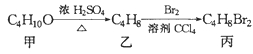
A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A. 乙烯与O2在银催化下生成环氧乙烷![]()
B. 乙烷与氯气制备氯乙烷
C. 苯和乙醇为原料,在一定条件下生产乙苯
D. 乙醇和浓硫酸共热制备乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
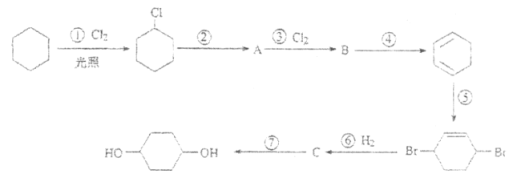
(1)写出反应④、⑦的化学方程式:
④__________________________________;
⑦__________________________________。
(2)上述七个反应中属于加成反应的有____________(填反应序号),A中所含有的官能团名称为____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳(沸点76.80C)为溶剂将碘从碘水中提取出来,具体过程如图所示。

请回答下列问题:
(1)操作①的名称为________________、_________________;
(2)向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是______________________;
(3)操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是_______________________。
(4)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要____________________,实验中温度计水银球所处位置为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。

(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验:
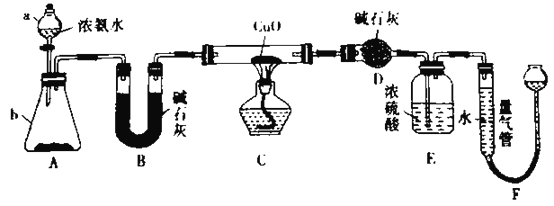
回答下列问题:
(l)仪器a的名称为____________,仪器b中可选择的试剂为___________。
(2)实验室中,利用装置A,还可制取的无色气体是___________(填标号)。
A.Cl2 B.O2 C.NO2 D.CO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明MH3具有_______性,装置C中发生反应的化学方程式为___。
(4)装置E中浓硫酸的作用是___________。
(5)读取气体体积前,应对装置F进行的操作是________。
(6)实验完毕,若测得装置D增重m g,装置F测定气体的体积为n L(已拆算成标准状况),则氨分子中氮、氢的原子个数比为_______________(用含m、n字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com