
����Ŀ��ijС��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ��(�г�װ��δ����)����ʵ�飺
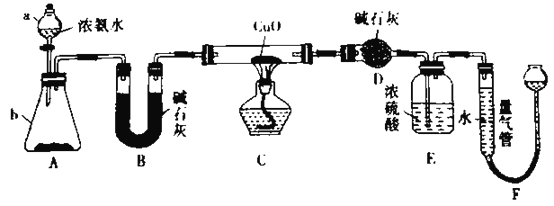
�ش��������⣺
(l)����a������Ϊ____________������b�п�ѡ����Լ�Ϊ___________��
(2)ʵ�����У�����װ��A��������ȡ����ɫ������___________(����)��
A.Cl2 B.O2 C.NO2 D.CO2
(3)ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�������������������֤��MH3����_______�ԣ�װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ___��
(4)װ��E��Ũ�����������___________��
(5)��ȡ�������ǰ��Ӧ��װ��F���еIJ�����________��
(6)ʵ����ϣ������װ��D����m g��װ��F�ⶨ��������Ϊn L(�Ѳ���ɱ�״��)�������е������ԭ�Ӹ�����Ϊ_______________(�ú�m��n��ĸ�Ĵ���ʽ��ʾ)��
���𰸡���Һ©�� �����ƻ��������ƹ�����ʯ�� BD ��ԭ 2NH3+3CuO![]() 3Cu+N2+3H2O ����δ��Ӧ�İ�������ֹF��ˮ��������D ���������ƶ��ұ�©����ʹ��������Һ����ƽ
3Cu+N2+3H2O ����δ��Ӧ�İ�������ֹF��ˮ��������D ���������ƶ��ұ�©����ʹ��������Һ����ƽ ![]()
��������
(1)���������Ĺ����֪������a�Ƿ�Һ©����Ũ��ˮ��������ʯ�ҡ��������ƹ��塢��ʯ�ҵ���ȡ������������b�п�ѡ����Լ�Ϊ�����ƻ��������ƹ�����ʯ�ң�
(2)װ��A��һ�ֹ���+Һ�巴Ӧ����Ҫ���ȵ����巢��װ�ã�����������ȡH2��CO2��NO2�ȣ���������H2O2��MnO2����ȡO2������ע������ɫ���壬������NO2����ѡBD��
(3)��ɫCuO��ĩ��Ϊ��ɫ���壬˵����ɫ��CuO����ԭΪCu��ͬʱNH3������ΪN2��֤����NH3���л�ԭ��:2NH3+3CuO![]() 3Cu+N2+3H2O��
3Cu+N2+3H2O��
(4)ʵ����Ҫͨ������Dװ�÷�Ӧǰ�������������Ϊ��������ԭ�����ʵ����ļ������ݣ�����Eװ�þ��и���D��F�����ã���ֹF�е�ˮ��������D�У�ͬʱ����δ��Ӧ��NH3���յ����ʴ�Ϊ����δ��Ӧ�İ�������ֹF��ˮ��������D��
(5)�ⶨ�������ռ��������ʱҪ��֤װ��������ѹǿ�����ѹ��ȣ�������Ҫ�����������ƶ��ұ�©����ʹ��������Һ����ƽ��
(6)D������������NH3��ԭCuO���ɵ�ˮ��������
n(H)=![]() ��2=
��2=![]() mol��
mol��
n(N)=![]() ��2=
��2= ![]() mol��
mol��
���������е������ԭ�Ӹ�����Ϊ:![]() mol��
mol��![]() mol =
mol =![]() ��
��


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������������̽��NH3�����ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������һ������������档�±��ж�ʵ�����������Ľ�����ȷ����(����)

ѡ�� | ʵ������ | ���� |
A | Ũ���ḽ���������� | NH3��Ũ���ᷴӦ������NH4Cl���� |
B | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
C | �Ȼ�����Һ����� | ����Һһ����AlCl3��Һ |
D | �����ʯ����ֽ����ɫ��ʪ���ʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�124 g P4������P��P����ĿΪ4NA
B. 100 mL 1mol��L1FeCl3��Һ������Fe3+����ĿΪ0.1NA
C. ��״���£�11.2 L�������ϩ������к���ԭ����ĿΪ2NA
D. �ܱ������У�2 mol SO2��1 mol O2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����( )��
A.��Ũ������������̷�Ӧ��ȡ����������MnO2+4HCl![]() Mn2+ + 2Cl-+ Cl2��+2H2O
Mn2+ + 2Cl-+ Cl2��+2H2O
B.��NaHCO3��Һ�еμ�����Ca(OH)2��![]() + Ca2+ + OH�T CaCO3��+ H2O
+ Ca2+ + OH�T CaCO3��+ H2O
C.������ˮ��Ӧ��Cl2 + H2O �T 2H+ + Cl- +ClO-
D.NaClO��Һ��ͨ��������SO2��3ClO��+H2O+SO2�TCl��+![]() +2HClO
+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��Ũ������ֳ������ʣ������У���Ӧ��ϵ��ȷ���ǣ� ��
A. �ڿ����г��ھ��õ�Ũ���ᣬ��Һ��������![]() �ѻӷ���
�ѻӷ���![]()
B. �ڼ���������ͭ��Ũ���ᷴӦ![]() ǿ�����ԡ�����
ǿ�����ԡ�����![]()
C. ������Ũ���ᷴӦ���к���״��̿����![]() ��ˮ��
��ˮ��![]()
D. Ũ�������������������ϣ���������ɫ��ɰ�ɫ![]() ��ˮ��
��ˮ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ɫ��Һ�����п��ܺ���Fe3+��Al3+��Fe2+��Mg2+��Cu2+��NH4����K+��CO32����SO42�������ӵļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й�������ͼ��ʾ��

���������ͼ�ƶ���
��1��ԭ��Һ��һ�����ڵ���������_______________����___(����������������������)�ԡ�
��2��ʵ����в�����ɫ��ζ�����������Ļ�ѧ����ʽΪ__________________________________��
��3��д��ʵ�����A���Ӧ�����Ļ�ѧʽ��__________��
��4��д��ʵ���������A��B��������������Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaSO4������Һ�У�����Na2SO4(s)���ﵽ�ܽ�ƽ��ʱ�����й�ϵʽ��ȷ����( )
A. c(Ba2��)��c(SO42-)
B. c(Ba2��)��c(SO42-)��c(Ba2��)��c(SO42-)��Ksp(BaSO4)
C. c(Ba2��)��c(SO42-)��[Ksp(BaSO4)]1/2
D. c(Ba2��)��c(SO42-)��c(Ba2��)��c(SO42-)��Ksp(BaSO4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��Ϊ�˽�ӹ�ҵ�����ᴿ��ķ������������й����ϣ�Br2�ķе�Ϊ59�棬����ˮ���ж��Ժ�ǿ��ʴ�ԡ����Dzι��������̺����������װ�ü�ͼ��
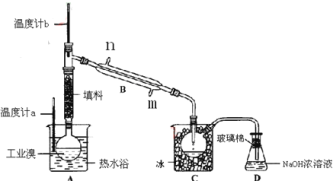
(1)װ��Bֱ�������ܽ�ˮ����______(����������������)��װ��D��������_________��
(2)��AԲ����ƿ�м���һ������ҵ���2СƬ���Ƭ���������Ƭ��������_________���������һ��ʱ��������Ǽ����Ƭ��Ӧ�ò�ȡ����ȷ������_______(����ȷ�𰸱��)��A���������� B����ȴ�� C�����貹�� D����������
(3)����ʵ��װ�����������Ӿ��������������ܣ���ԭ����_____________________��
(4)ʵ��װ�����������ã�Ҫ�ﵽ�ᴿ���Ŀ�ģ���������ο��ƹؼ�������___________��
(5)װ��C�����ã�_____________________��װ��D��������________________________��
(6)�ᴿҺ��ҲҪ�õ���Һ��������Һ©����ʹ��ǰ����ϴ�ɾ���___________����CCl4��ȡ��ʱ������Ӧ�ôӷ�Һ©����______________(�����Ͽڵ����������¿ڷų���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ô���ˮ(������Ҫ�ɷ�ΪNaCl�����Ʊ�NaHCO3���壬������ͼ��
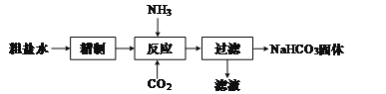
��1������������Ϊ�˳�ȥ����ˮ�к��е�Ca2+��Mg2+��SO![]() ���������ӣ������NaCl������Һ���������������а������ӡ����ˡ�����Ũ���Ȳ�������Ҫ������Լ�Ϊ�Թ����Ģ�Na2CO3����BaCl2�������ᡢ��NaOH�������Լ����Ⱥ�˳��Ϊ___������ţ���
���������ӣ������NaCl������Һ���������������а������ӡ����ˡ�����Ũ���Ȳ�������Ҫ������Լ�Ϊ�Թ����Ģ�Na2CO3����BaCl2�������ᡢ��NaOH�������Լ����Ⱥ�˳��Ϊ___������ţ���
��2����֪����Ӧ�����������С���һ������NH4HCO3��
�ڶ����ķ�Ӧ����ʽΪ��NH4HCO3+NaCl=NaHCO3��+NH4Cl��
�ٵ�һ����Ӧ�Ļ�ѧ����ʽΪ___��
�ڵڶ�����Ӧ�ܷ�����ԭ����___��
��3������������������Һ�м���NaCl����ͨ�백�������ˣ��õ����壬�ù�����ܺ���NaCl��NH4Cl������ù����к���NH4Cl�ķ�����___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com