
【题目】在BaSO4饱和溶液中,加入Na2SO4(s),达到溶解平衡时,下列关系式正确的是( )
A. c(Ba2+)=c(SO42-)
B. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4)
C. c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2
D. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)≠Ksp(BaSO4)
【答案】B
【解析】
常温下,在BaSO4饱和溶液中存在溶解平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-而抑制BaSO4溶解,结合电荷守恒分析解答。
Ba2+(aq)+SO42-(aq),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-而抑制BaSO4溶解,结合电荷守恒分析解答。
A.常温下,在BaSO4饱和溶液中存在溶解平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),故c(Ba2+)=c(SO42-)且c(Ba2+)·c(SO42-)=Ksp(BaSO4),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-使c(SO42-)增大,溶解平衡逆向移动,使c(Ba2+)减小,所以c(Ba2+)<c(SO42-),故A错误;
Ba2+(aq)+SO42-(aq),故c(Ba2+)=c(SO42-)且c(Ba2+)·c(SO42-)=Ksp(BaSO4),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-使c(SO42-)增大,溶解平衡逆向移动,使c(Ba2+)减小,所以c(Ba2+)<c(SO42-),故A错误;
B.根据A知,c(Ba2+)<c(SO42-),所以c(Ba2+)≠cSO42-),溶度积是温度的常数,故达到平衡时溶度积不变,故硫酸钡溶度积常数KSP(BaSO4)=c(Ba2+)c(SO42-),故B正确;
C.根据A知,加入硫酸钠溶液钡离子浓度和硫酸根离子浓度不再相等,所以c(Ba2+)≠cSO42-)故C错误;
D.根据B知,存在c(Ba2+)≠cSO42-),溶度积是温度的常数,故达到平衡时溶度积不变,故硫酸钡溶度积常数KSP(BaSO4)=c(Ba2+)c(SO42-),故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳(沸点76.80C)为溶剂将碘从碘水中提取出来,具体过程如图所示。

请回答下列问题:
(1)操作①的名称为________________、_________________;
(2)向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是______________________;
(3)操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是_______________________。
(4)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要____________________,实验中温度计水银球所处位置为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作流程如下:
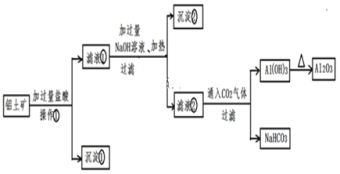
请回答下列问题:
(1)操作①的名称:____________;
(2)沉淀②的化学式:____________;
(3)写出沉淀①与NaOH溶液反应的化学方程式:__________;
(4)写出滤液②里通入过量CO2后生成沉淀的离子方程式: ______,能否将滤液②中通入过量CO2换成加入过量盐酸? ____ (填能或不能),其理由是_______(用化学方程式表示)。
Ⅱ.无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿为原料制备无水AlCl3的工艺流程如下:
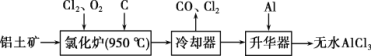
(1)铝在空气中有较强的抗腐蚀性,原因是___________________________。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为___________________________。
(3)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16g无水AlCl3样品溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32g。
①写出上述除杂过程中涉及的离子方程式______________、_______________。
②产品中AlCl3的质量分数为___________。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验:
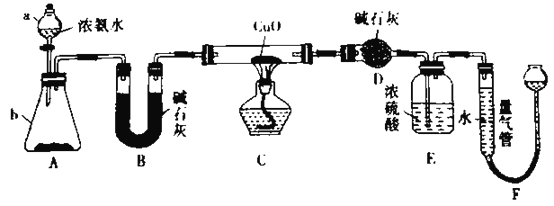
回答下列问题:
(l)仪器a的名称为____________,仪器b中可选择的试剂为___________。
(2)实验室中,利用装置A,还可制取的无色气体是___________(填标号)。
A.Cl2 B.O2 C.NO2 D.CO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明MH3具有_______性,装置C中发生反应的化学方程式为___。
(4)装置E中浓硫酸的作用是___________。
(5)读取气体体积前,应对装置F进行的操作是________。
(6)实验完毕,若测得装置D增重m g,装置F测定气体的体积为n L(已拆算成标准状况),则氨分子中氮、氢的原子个数比为_______________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF===KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是

A. 钢电极与电源的负极相连
B. 电解过程中需不断补充的X是KF
C. 阴极室与阳极室必须隔开
D. 氟氢化钾在氟化氢中可以电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Cu、Fe、Al三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_________方法区分晶体、准晶体和非晶体。
(2)基态Cu原子最高能层符号_________,Cu位于周期表________区;新制备的Cu(OH)2可将丙醛(CH3CH2CHO)氧化成丙酸,而自身还原成Cu2O,Cu2O中Cu元素的化合价为_________。1mol丙醛分子中含有的σ键的数目为_________,丙酸的沸点明显高于丙醛,其主要原因是_________________。
(3)已知:
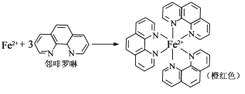
①Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为_________________,配位原子数为__。
②铁能与氮形成一种磁性材料,其晶胞结构如图,则该磁性材料的化学式为___________。
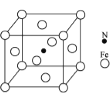
③尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]。尿素分子中C、N原子的杂化方式分别是________、_________;与NO3-互为等电子体的一种化合物是_________(写化学式)。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为______,列式表示Al单质的密度_________________gcm﹣3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知乙烯能发生以下转化:
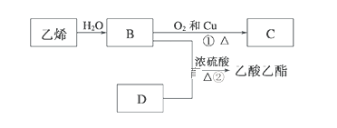
(1)B的结构简式为:________;
(2)C中官能团的名称:_______;
(3)①的反应类型:_________;
(4)乙烯与溴水反应的化学方程式为:__________;
(5)写出②的化学反应方程式:______________。
Ⅱ.今有相对分子质量为58的几种有机物,试写出符合条件的有机物的结构简式
(1)若该有机物为烃,则可能的结构简式为:_______、______。
(2)若该有机物是一种饱和一元醛,则其结构简式为:_______。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则有机物的结构简式为:________。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机可能是:______。(注羟基连在双键上的有机物极不稳定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名:
① 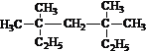 ___________________________;
___________________________;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
① 2,3-二甲基-4-乙基已烷 :_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com