
【题目】I.已知乙烯能发生以下转化:
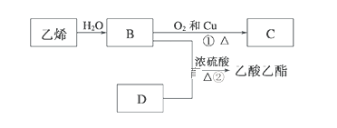
(1)B的结构简式为:________;
(2)C中官能团的名称:_______;
(3)①的反应类型:_________;
(4)乙烯与溴水反应的化学方程式为:__________;
(5)写出②的化学反应方程式:______________。
Ⅱ.今有相对分子质量为58的几种有机物,试写出符合条件的有机物的结构简式
(1)若该有机物为烃,则可能的结构简式为:_______、______。
(2)若该有机物是一种饱和一元醛,则其结构简式为:_______。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则有机物的结构简式为:________。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机可能是:______。(注羟基连在双键上的有机物极不稳定)
【答案】CH3CH2OH 醛基 氧化反应 CH2=CH2+Br2![]() CH2BrCH2Br CH3CH2OH+CH3COOH
CH2BrCH2Br CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O CH3CH2CH2CH3 CH3CH(CH3)CH3 CH3CH2CHO OHC-HCO CH2=CHCH2OH
CH3COOCH2CH3+H2O CH3CH2CH2CH3 CH3CH(CH3)CH3 CH3CH2CHO OHC-HCO CH2=CHCH2OH
【解析】
I.BD发生酯化反应生成CH3COOCH2CH3,逆推出:乙烯和水发生加成反应生成B为CH3CH2OH,B发生催化氧化反应生成C为CH3CHO,D为CH3COOH。
Ⅱ.(1)某有机物的相对分子质量为58,只由碳、氢两元素组成,根据商余法确定其分子式,写出结构简式;
(2)若该有机物是一种饱和一元醛,设通式为CnH2nO,结合相对分子质量计算确定有机物分子式,写出可能的结构简式;
(3)lmol该有机物与足量的银氨溶液作用可析出4molAg,可知有机物为甲醛或1个有机物分子中含有2个醛基,结合相对分子质量来确定分子式和结构简式;
(4)该有机物能与金属钠反应,说明含有羟基或羧基,又能使溴的四氯化碳溶液褪色,说明含有碳碳双键,其相对分子质量是58,该有机物中不含羧基,含有羟基,再结合相对分子质量判断其结构简式。
I.(1)B为乙醇,结构简式为:CH3CH2OH;
(2)C为CH3CHO,官能团的名称:醛基;
(3)B发生催化氧化反应生成C为CH3CHO,2CH3CH2OH+O2![]() 2CH3CHO+2H2O,①的反应类型:氧化反应;
2CH3CHO+2H2O,①的反应类型:氧化反应;
(4)乙烯与溴水发生加成反应,乙烯与溴水反应的化学方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br;
(5)②的化学反应方程式:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
Ⅱ.(1)某有机物的相对分子质量为58,只由碳、氢两元素组成,根据商余法58/14=4…2可知其分子式为:C4H10,为丁烷,丁烷结构简式有:CH3CH2CH2CH3、CH3CH(CH3)CH3;
(2)该有机物是一种饱和一元醛,分子量是58,设通式为CnH2nO,则14n+16=58,解得:n=3,则该有机物的结构简式为:CH3CH2CHO;
(3)lmol该有机物与足量的银氨溶液作用,析出4molAg,可知有机物为甲醛或1个有机物分子中含有2个醛基,相对分子质量为M=58,不可能为甲醛,分子式为C2H2O2,结构简式为OHC-CHO;
(4)若该有机物能与金属钠反应,说明含有羟基或羧基,又能使溴的四氯化碳溶液褪色,说明含有碳碳双键,其相对分子质量是58,所以该有机物中不含羧基,含有羟基,则该有机物的结构简式为:CH2=CH-CH2OH。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在BaSO4饱和溶液中,加入Na2SO4(s),达到溶解平衡时,下列关系式正确的是( )
A. c(Ba2+)=c(SO42-)
B. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4)
C. c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2
D. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)≠Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
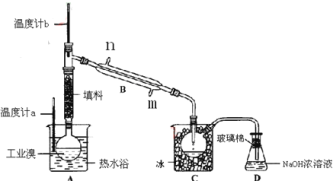
(1)装置B直形冷凝管进水方向______(填“Ⅱ”或“Ⅲ”),装置D的名称是_________。
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_______(填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________________。
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:___________。
(5)装置C的作用:_____________________。装置D的作用是________________________。
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并___________;用CCl4提取溴时,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘盐中含有KIO3,其能发生反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,下列有关该反应的说法正确的是( )
A.H2SO4是氧化剂
B.KIO3发生还原反应
C.I2的还原性大于I-
D.每生成0.6molI2,反应转移电子数为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;
(2)卤代烃:_____________;
(3)醇:_______________ ;
(4)酚:_____________;
(5)醛:_______________ ;
(6)酮:_____________;
(7)羧酸:_____________ ;
(8)酯:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如图:
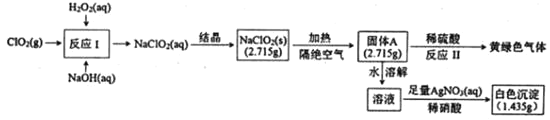
已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为___,固体A的成分是___(用化学式表示)。
(2)反应I的离子方程式为___。
(3)反应Ⅱ的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用粗盐水(溶质主要成分为NaCl),制备NaHCO3固体,流程如图:
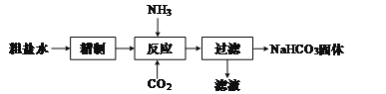
(1)“精制”是为了除去粗盐水中含有的Ca2+、Mg2+、SO![]() 等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
(2)已知“反应”分两步进行。第一步生成NH4HCO3;
第二步的反应方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
①第一步反应的化学方程式为___。
②第二步反应能发生的原因是___。
(3)向“过滤”所得滤液中加入NaCl,并通入氨气,过滤,得到固体,该固体可能含有NaCl和NH4Cl,检验该固体中含有NH4Cl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com