
【题目】实验室用粗盐水(溶质主要成分为NaCl),制备NaHCO3固体,流程如图:
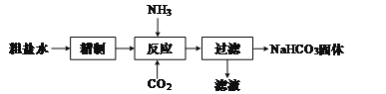
(1)“精制”是为了除去粗盐水中含有的Ca2+、Mg2+、SO![]() 等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
(2)已知“反应”分两步进行。第一步生成NH4HCO3;
第二步的反应方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
①第一步反应的化学方程式为___。
②第二步反应能发生的原因是___。
(3)向“过滤”所得滤液中加入NaCl,并通入氨气,过滤,得到固体,该固体可能含有NaCl和NH4Cl,检验该固体中含有NH4Cl的方法是___。
【答案】②①④③或②④①③或④②①③ NH3+H2O+CO2=NH4HCO3(或NH3·H2O+CO2=NH4HCO3) 因为有沉淀生成 取少许固体放入试管中,将试管在酒精灯上充分加热,若试管内有白烟,试管壁上有固体凝结,则固体中含有NH4Cl或向装有固体的试管中加入NaOH浓溶液,并加热,若产生了能使湿润红色石蕊变蓝的气体,则含有NH4Cl
【解析】
粗盐中的杂质使用沉淀法除去;先利用二氧化碳是酸性气体、氨气是碱性气体,反应生成NH4HCO3,再利用NaHCO3的溶解度小,生成NaHCO3固体。
(1)用氯化钡除去硫酸根离子,碳酸钠除去钙离子和过量的钡离子,氢氧化钠除去镁离子,过滤后,最后加盐酸除去过量的碳酸根离子,必须满足碳酸钠在氯化钡后面加,以便把过量的氯化钡除去,所以加入试剂的先后顺序为②①④③或②④①③或④②①③;
(2)①第一步反应用NH3、H2O和CO2生成NH4HCO3,第一步的化学方程式为NH3+H2O+CO2=NH4HCO3(或NH3·H2O+CO2=NH4HCO3);
②第二步反应生成的NaHCO3溶解度小,相当于生成了沉淀,所以原因为有沉淀生成;
(3) NH4Cl加热时能分解成氨气和氯化氢,气体遇冷后又能生成NH4Cl固体,铵盐能与碱反应,加热时生成氨气,使湿润红色石蕊变蓝,所以检验NH4Cl的方法是:取少许固体放入试管中,将试管在酒精灯上充分加热,若试管内有白烟,试管壁上有固体凝结,则固体中含有NH4Cl或向装有固体的试管中加入NaOH浓溶液,并加热,若产生了能使湿润红色石蕊变蓝的气体,则含有NH4Cl。


科目:高中化学 来源: 题型:
【题目】某小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验:
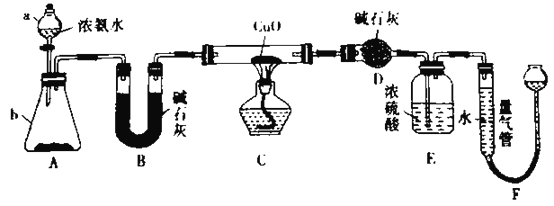
回答下列问题:
(l)仪器a的名称为____________,仪器b中可选择的试剂为___________。
(2)实验室中,利用装置A,还可制取的无色气体是___________(填标号)。
A.Cl2 B.O2 C.NO2 D.CO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明MH3具有_______性,装置C中发生反应的化学方程式为___。
(4)装置E中浓硫酸的作用是___________。
(5)读取气体体积前,应对装置F进行的操作是________。
(6)实验完毕,若测得装置D增重m g,装置F测定气体的体积为n L(已拆算成标准状况),则氨分子中氮、氢的原子个数比为_______________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知乙烯能发生以下转化:
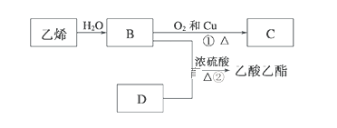
(1)B的结构简式为:________;
(2)C中官能团的名称:_______;
(3)①的反应类型:_________;
(4)乙烯与溴水反应的化学方程式为:__________;
(5)写出②的化学反应方程式:______________。
Ⅱ.今有相对分子质量为58的几种有机物,试写出符合条件的有机物的结构简式
(1)若该有机物为烃,则可能的结构简式为:_______、______。
(2)若该有机物是一种饱和一元醛,则其结构简式为:_______。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则有机物的结构简式为:________。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机可能是:______。(注羟基连在双键上的有机物极不稳定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C. N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1.3g乙炔和苯蒸汽混合气体中的碳氢键(C﹣H)数为0.1NA
B.一定条件下,2 molSO2与1 molO2反应生成的SO3分子数为2NA
C.1 L0.1 molL﹣1的乙酸溶液中含H+的数量为0.1NA
D.2.24L的CO和N2混合气体中含有的质子数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种有机化合物,分子式都是C9H11O2N。
(1)化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基(—CH3)。化合物A的结构简式是____。
(2)化合物B是某种芳香烃与混酸在加热条件下进行硝化反应后的唯一产物。化合物B的结构简式是____。
(3)化合物C能发生银镜反应、水解反应,且 氢核磁共振谱显示只有4组峰。化合物C的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名:
① 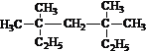 ___________________________;
___________________________;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
① 2,3-二甲基-4-乙基已烷 :_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Mg、Al、Fe四种金属中两种组成的混合物12g,与足量盐酸反应放出H2 0.5 g(标准状况),则混合物中必定含有的金属是
A.钠B.镁C.铝D.铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀。
①实验i中的现象是____。
②用化学用语解释实验i中的现象:____。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是 __________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a.以上实验表明:在____条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是____________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是 _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com