
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1.3g乙炔和苯蒸汽混合气体中的碳氢键(C﹣H)数为0.1NA
B.一定条件下,2 molSO2与1 molO2反应生成的SO3分子数为2NA
C.1 L0.1 molL﹣1的乙酸溶液中含H+的数量为0.1NA
D.2.24L的CO和N2混合气体中含有的质子数为1.4NA
【答案】A
【解析】
A.乙炔和苯具有相同最简式CH,1molCH含有1个C-H键;
B.二氧化硫与氧气反应为可逆反应,可逆反应不能进行到底;
C.乙酸为弱电解质,部分电离;
D.气体状况未知。
A.1.3g乙炔和苯蒸汽混合气体含有CH物质的量为:![]() =0.1mol,含有碳氢键(C﹣H)数为0.1NA,故A正确;
=0.1mol,含有碳氢键(C﹣H)数为0.1NA,故A正确;
B.二氧化硫与氧气反应为可逆反应,可逆反应不能进行到底,所以一定条件下,2 mol SO2与1 mol O2反应生成的SO3分子数小于2NA,故B错误;
C.乙酸为弱电解质,部分电离,1 L0.1 molL﹣1的乙酸溶液中含H+的数量小于0.1NA,故C错误;
D.气体状况未知,无法计算混合气体物质的量和含有质子数,故D错误;
故选:A。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A. 在空气中敞口久置的浓硫酸,溶液质量增大![]() 难挥发性
难挥发性![]()
B. 在加热条件下铜与浓硫酸反应![]() 强氧化性、酸性
强氧化性、酸性![]()
C. 蔗糖与浓硫酸反应中有海绵状的炭生成![]() 吸水性
吸水性![]()
D. 浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色![]() 脱水性
脱水性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘盐中含有KIO3,其能发生反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,下列有关该反应的说法正确的是( )
A.H2SO4是氧化剂
B.KIO3发生还原反应
C.I2的还原性大于I-
D.每生成0.6molI2,反应转移电子数为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如图:
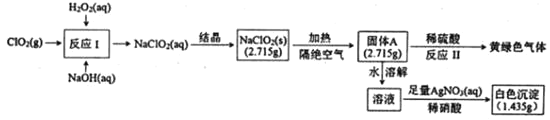
已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为___,固体A的成分是___(用化学式表示)。
(2)反应I的离子方程式为___。
(3)反应Ⅱ的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示,下列关于普伐他汀的描述正确的是

A. 能与FeCl3溶液发生显色反应B. 常温下易溶于水
C. 能发生加成、取代、消去反应D. 1mol 该物质最多可与1mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用粗盐水(溶质主要成分为NaCl),制备NaHCO3固体,流程如图:
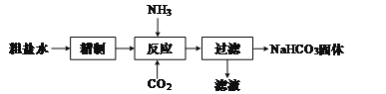
(1)“精制”是为了除去粗盐水中含有的Ca2+、Mg2+、SO![]() 等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
(2)已知“反应”分两步进行。第一步生成NH4HCO3;
第二步的反应方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
①第一步反应的化学方程式为___。
②第二步反应能发生的原因是___。
(3)向“过滤”所得滤液中加入NaCl,并通入氨气,过滤,得到固体,该固体可能含有NaCl和NH4Cl,检验该固体中含有NH4Cl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
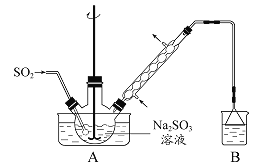
(1)装置B 的烧杯中应加入的溶液是 。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是
。②冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。②滤渣的主要成分有 、 (填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁磁粉Fe3O4(可能含有Fe2O3或FeO杂质),为确定其纯度,称取23.28g该样品利用图1装置进行实验探究。
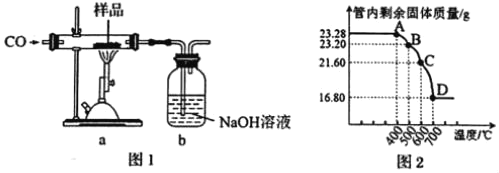
已知:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
请回答:
(1)上述实验装置存在一个明显缺陷是___。
(2)利用仪器测定并绘制出反应过程中a装置中玻璃管内的固体质量随温度的变化曲线(图2),样品中含有的杂质成分是___(填化学式)。
(3)上述实验过程中,CO除作为反应物外,还起到的作用是___。
A.实验开始时,排尽装置中的空气,防止加热时发生爆炸
B.防止b中的溶液倒吸入a中
C.停止加热后,继续通CO气体,防止生成物被氧化
D.将产生的CO2全部赶入装置b中,以提高实验的精确度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.侯氏制碱法:NH3+CO2+H2O=![]() +
+ ![]()
B.小苏打溶液与稀硫酸混合:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3: ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com