
【题目】Na、Mg、Al、Fe四种金属中两种组成的混合物12g,与足量盐酸反应放出H2 0.5 g(标准状况),则混合物中必定含有的金属是
A.钠B.镁C.铝D.铁
【答案】D
【解析】
假设金属都是二价金属,其通式为R,金属和盐酸反应方程式为R+2HCl=RCl2+H2↑,n(H2)=![]() =0.25mol,根据方程式知,n(R)=n(H2)=0.25mol,则R的平均摩尔质量=
=0.25mol,根据方程式知,n(R)=n(H2)=0.25mol,则R的平均摩尔质量=![]() =
=![]() =48g/mol,混合物中金属的摩尔质量应该有大于48g/mol和小于48g/mol的,如果将Na换算为+2价时,其摩尔质量变为46g/mol<48g/mol,镁的摩尔质量为24g/mol<48g/mol,如果将Al换算为+2价时,其摩尔质量变为18g/mol<48g/mol,Fe的摩尔质量为56g/mol>48g/mol,其中小于48g/mol的有三种,而大于48g/mol只有铁,所以一定含有Fe,故选D。
=48g/mol,混合物中金属的摩尔质量应该有大于48g/mol和小于48g/mol的,如果将Na换算为+2价时,其摩尔质量变为46g/mol<48g/mol,镁的摩尔质量为24g/mol<48g/mol,如果将Al换算为+2价时,其摩尔质量变为18g/mol<48g/mol,Fe的摩尔质量为56g/mol>48g/mol,其中小于48g/mol的有三种,而大于48g/mol只有铁,所以一定含有Fe,故选D。


科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
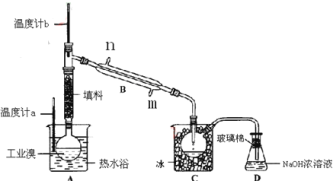
(1)装置B直形冷凝管进水方向______(填“Ⅱ”或“Ⅲ”),装置D的名称是_________。
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_______(填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________________。
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:___________。
(5)装置C的作用:_____________________。装置D的作用是________________________。
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并___________;用CCl4提取溴时,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用粗盐水(溶质主要成分为NaCl),制备NaHCO3固体,流程如图:
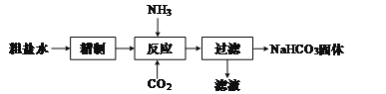
(1)“精制”是为了除去粗盐水中含有的Ca2+、Mg2+、SO![]() 等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
(2)已知“反应”分两步进行。第一步生成NH4HCO3;
第二步的反应方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
①第一步反应的化学方程式为___。
②第二步反应能发生的原因是___。
(3)向“过滤”所得滤液中加入NaCl,并通入氨气,过滤,得到固体,该固体可能含有NaCl和NH4Cl,检验该固体中含有NH4Cl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是海带中提取碘的流程图:
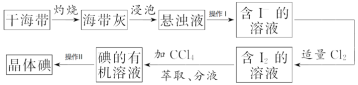
回答下列问题。
(1)干海带在_____________________中灼烧(填仪器名称)
(2)操作I名称为_____________________
(3)分液漏斗在使用前须清洗干净并_____________________,在本实验分离过程中,碘的四氯化碳应该从分液漏斗的_____________________(填“上口倒出”或“下口放出”)
(4)操作II名称为_____________________,该操作中加入碎瓷片的作用是_____________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____________________(填标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
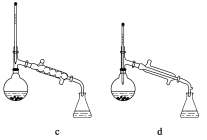
(5)在操作II中,仪器选择及安装都最合理的是_____________________(填标号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁磁粉Fe3O4(可能含有Fe2O3或FeO杂质),为确定其纯度,称取23.28g该样品利用图1装置进行实验探究。
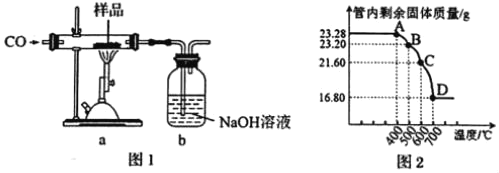
已知:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
请回答:
(1)上述实验装置存在一个明显缺陷是___。
(2)利用仪器测定并绘制出反应过程中a装置中玻璃管内的固体质量随温度的变化曲线(图2),样品中含有的杂质成分是___(填化学式)。
(3)上述实验过程中,CO除作为反应物外,还起到的作用是___。
A.实验开始时,排尽装置中的空气,防止加热时发生爆炸
B.防止b中的溶液倒吸入a中
C.停止加热后,继续通CO气体,防止生成物被氧化
D.将产生的CO2全部赶入装置b中,以提高实验的精确度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系:NH3N2NO NO2HNO3。回答下列问题:
(1)N元素在元素周期表中的位置为_______;
(2)上述四种气体只能用排水法收集的是_______(填化学式,下同),只能用排空气法收集的是______;
(3)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是_____;
A. 酸雨 B. 光化学烟雾 C. 白色污染 D. 臭氧层空洞
(4)NO2形成酸雨的化学方程式为______;
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程______;
(6)若将12.8 g铜与 50 mL一定浓度的浓硝酸反应,两者恰好完全反应共产生气体5.6 L(标准状况),计算此浓硝酸的物质的量浓度_______(写出解题过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
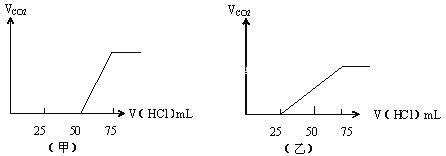
【题目】有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:
试
(1)NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是甲:________,其物质的量之比是:________;乙:__________,其物质的量之比是:__________。
(2)且在两种情况下产生的CO2气体(标准状况)各是甲:________mL;乙:_________mL。
(3)原NaOH溶液的物质的量浓度是_________;若以Na2O2固体溶于水配得100mL溶液需称量Na2O2_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):
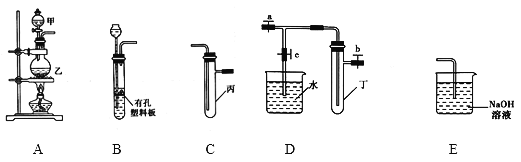
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后______,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有______(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置___作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是__。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器甲的名称为____,A装置中发生反应的离子方程式为____。
②C中说明Cl-和S2-的还原性强弱的实验现象_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com