
【题目】工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF===KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是

A. 钢电极与电源的负极相连
B. 电解过程中需不断补充的X是KF
C. 阴极室与阳极室必须隔开
D. 氟氢化钾在氟化氢中可以电离
【答案】B
【解析】
根据装置图,钢电极上产生H2,碳电极上产生F2,然后根据电解原理进行分析和判断;
A、根据装置图,KHF2中H元素显+1价,钢电极上析出H2,表明钢电极上发生得电子的还原反应,即钢电极是电解池的阴极,钢电极与电源的负极相连,故A说法正确;
B、根据装置图,逸出的气体为H2和F2,说明电解质无水溶液中减少的是氢和氟元素,因此电解过程需要不断补充的X是HF,故B说法错误;
C、阳极室生成氟气,阴极室产生H2,二者接触发生剧烈反应甚至爆炸,因此必须隔开防止氟气与氢气接触,故C说法正确;
D、由氟氢化钾的氟化氢无水溶液可以导电,可推知氟氢化钾在氟化氢中发生电离,故D说法正确。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种安全可充电的柔性水系钠离子电池,可用生理盐水或细胞培养基为电解质,电池放电的总反应式为:Na0.44MnO2+NaTi2(PO4)3=Na0.44-xMnO2+Na1+xTi2(PO4)3,其工作原理如下图。

下列说法错误的是
A. 放电时,Cl-向X极移动
B. 该电池充电时Y极应该与电源的正极相连
C. 充电时,阴极反应为:NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. 该电池可能作为可植入人体的电子医疗设备的电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铁矿石(Fe2O3),可以制得Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)基态Fe3+的价电子排布式为___________。
(2)O、S、C三种元素的电负性由大到小的顺序为___________,Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃。Fe(CO)5晶体类型是___________。
(3)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的分子为___________(任写一种),SCN-中碳原子的杂化类型为___________。第一电离能I1(N)___________I1(O)(填“大于”、“小于”或“等于”),理由是___________。
(4)钾晶体(其晶胞结构如图所示)的晶胞参数为apm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为___________pm,晶体钾的密度计算式是___________g/m3(设NA为阿伏加德罗常数的值)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作可达到实验目的的是
A. 用长颈漏斗可分离乙酸乙酯和饱和碳酸钠溶液
B. 将NaOH溶液滴加到FeCl3溶液中可制备Fe(OH)3胶体
C. 用浓盐酸和MnO2反应制备纯净的Cl2,气体产物先通过浓硫酸再通过饱和食盐水
D. 除去Na2CO3固体中的NaHCO3,可将固体加热至恒重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:
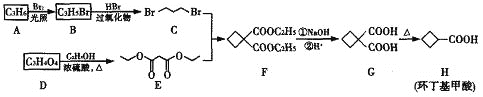
请回答下列问题:
(1)环丁基甲酸的分子式为____________________。
(2)环丁基甲酸由原料A和D经一系列反应制得,A为烯烃,则A的名称为______,D物质的官能团为_______。
(3)写出D→E的化学方程式________________________。
(4)C+E→F的反应类型为_________________________。
(5)化合物W为H的同分异构体,能发生银镜反应且只含酯基一种官能团,则所有符合条件的W的结构简式为_____________。
(6)参照上述合成路线,以 ![]() 和E为原料(无机试剂任选),设计制备
和E为原料(无机试剂任选),设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,体积不变的密闭容器中,可逆反应2SO2(g)+O2(g)![]() 2SO3(g),达到化学平衡时,下列说法一定正确的是
2SO3(g),达到化学平衡时,下列说法一定正确的是
A. SO2与O2 100%转化为SO3 B. 正逆反应速率都为零
C. 气体总质量保持不变 D. SO2与O2的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com