
【题目】下列短周期元素的简单离子都能破坏水的电离平衡的是( )
A. S2﹣、Na+B. K+、H+C. Al3+、S2﹣D. Na+、Cl﹣
【答案】C
【解析】
A.S2﹣为弱酸H2S对应的阴离子,可以发生水解:S2﹣+H2O![]() HS-+OH﹣,破坏水的电离平衡;Na+为强碱NaOH对应的阳离子,不能发生水解,不能破坏水的电离平衡;故A错误;
HS-+OH﹣,破坏水的电离平衡;Na+为强碱NaOH对应的阳离子,不能发生水解,不能破坏水的电离平衡;故A错误;
B.K+为强碱KOH对应的阳离子,不能发生水解,不能破坏水的电离平衡;水的电离方程式为H2O![]() H++OH-,氢离子使平衡向逆反应方向移动,破坏水的电离平衡,故B错误;
H++OH-,氢离子使平衡向逆反应方向移动,破坏水的电离平衡,故B错误;
C.Al3+为弱碱Al(OH)3对应的阳离子,可以发生水解:Al3++3H2O![]() Al(OH)3+3H+,破坏水的电离平衡;S2﹣为弱酸H2S对应的阴离子,可以发生水解:S2﹣+H2O
Al(OH)3+3H+,破坏水的电离平衡;S2﹣为弱酸H2S对应的阴离子,可以发生水解:S2﹣+H2O![]() HS-+OH﹣,破坏水的电离平衡;故C正确;
HS-+OH﹣,破坏水的电离平衡;故C正确;
D.Na+为强碱NaOH对应的阳离子,不能发生水解,不能破坏水的电离平衡;Cl-为强酸HCl对应的阴离子,不能发生水解,不能破坏水的电离平衡;故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
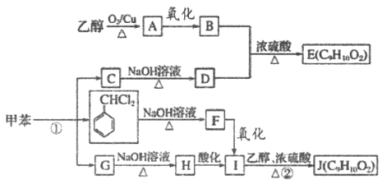
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水。
②G的核磁共振氢谱表明其只有三种不同化学环境的氢。
请回答下列问题:
(1)用甲苯制备TNT的反应方程式:_____________。
(2)D的名称是_____________。
(3)写出B+D→E的反应方程式:_____________,
(4)①的反应条件为_____________。
(5)F的结构简式为_____________。
(6)E、J有多种同分异构体,写出符合下列条件的2种同分异构体的结构简式_____________、_____________。
①与E、J属同类物质
②苯环上有两个取代基
③核磁共振氢谱表明苯环上只有两组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2和N2O4之间发生反应:N2O4![]() 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
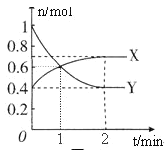
(1)曲线____________(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是________________,该反应达最大限度时Y的转化率_______。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.3 mol·L-1·min-1,乙中y(N2O4)=0.2 mol·L-1·min-1,则__________中反应更快。
(3)下列描述能表示反应达平衡状态的是______________________。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
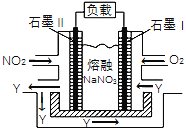
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如右图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是______________(填“正极”或“负极”),石墨Ⅱ的电极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A. 在空气中敞口久置的浓硫酸,溶液质量增大![]() 难挥发性
难挥发性![]()
B. 在加热条件下铜与浓硫酸反应![]() 强氧化性、酸性
强氧化性、酸性![]()
C. 蔗糖与浓硫酸反应中有海绵状的炭生成![]() 吸水性
吸水性![]()
D. 浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色![]() 脱水性
脱水性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一定温度下,在容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。回答下列问题:
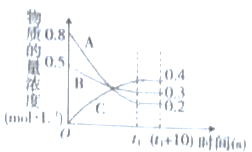
(1)该反应的化学方程式为_________。
(2)0~t1s内,B气体的平均反应速率为____。
(3)(t1+10)s时,A气体的转化率为__________,此时v正(A)_____v逆(B)(填“>”“<”或“=")。
(4)下列关于该反应的说法正确的是__________(填标号)。
a.t1时刻,该反应的正反应和逆反应均已停止
b.t1时刻之前,B气体的消耗速率大于它的生成速率
c.t1时刻,C气体的正反应速率等于它的逆反应速率
(5)容器中,(t1+10)s时的压强与起始时的压强之比为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在BaSO4饱和溶液中,加入Na2SO4(s),达到溶解平衡时,下列关系式正确的是( )
A. c(Ba2+)=c(SO42-)
B. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4)
C. c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2
D. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)≠Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
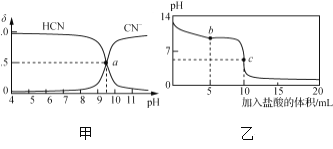
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘盐中含有KIO3,其能发生反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,下列有关该反应的说法正确的是( )
A.H2SO4是氧化剂
B.KIO3发生还原反应
C.I2的还原性大于I-
D.每生成0.6molI2,反应转移电子数为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
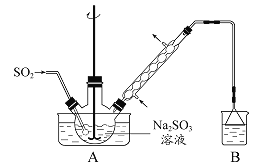
(1)装置B 的烧杯中应加入的溶液是 。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是
。②冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。②滤渣的主要成分有 、 (填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com