
【题目】NO2和N2O4之间发生反应:N2O4![]() 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
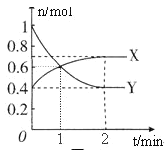
(1)曲线____________(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是________________,该反应达最大限度时Y的转化率_______。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.3 mol·L-1·min-1,乙中y(N2O4)=0.2 mol·L-1·min-1,则__________中反应更快。
(3)下列描述能表示反应达平衡状态的是______________________。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
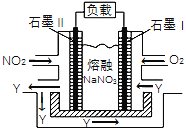
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如右图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是______________(填“正极”或“负极”),石墨Ⅱ的电极反应式为_________________________________。
【答案】Y 0.1mol·L-1·min-1 60% 乙 BD 正极 NO2-e-+NO3-═N2O5
【解析】
(1)根据图知,1min时△n(X)=(0.6-0.4)mol=0.2mol、△n(Y)=(1.0-0.6)mol=0.4mol,X、Y的计量数之比为0.2mol:0.4mol=1:2,据此结合反判断X、Y;根据v=![]() 计算v(X);该反应达限度时,消耗的Y为0.6mol,转化率=
计算v(X);该反应达限度时,消耗的Y为0.6mol,转化率=![]() ×100%;
×100%;
(2)化学反应速率与化学计量数成正比,结合转化成同一种物质比较反应速率大小;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此判断;
(4)该燃料电池中,负极上通入NO2,正极上通入O2,根据电解质知,负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-。
(1)根据图知,1min时△n(X)=(0.6-0.4)mol=0.2mol、△n(Y)=(1.0-0.6)mol=0.4mol,X、Y的计量数之比为0.2mol:0.4mol=1:2,根据反应N2O4(g)(无色)2NO2(g)(红棕色)可知,曲线Y表示NO2的物质的量随时间变化关系曲线;在0到1min中内用X表示该反应的速率为:v(X)=![]() =0.1mol/(Lmin);该反应达到最大限度时,Y的物质的量为0.4mol,则Y的转化率为:
=0.1mol/(Lmin);该反应达到最大限度时,Y的物质的量为0.4mol,则Y的转化率为:![]() ×100%=60%;
×100%=60%;
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3molL-1min-1,乙中v(N2O4)=0.2molL-1min-1,转化成v(NO2)=0.4molL-1min-1,所以乙中反应更快;
(3)A.容器中X与Y的物质的量相等,无法判断各组分的浓度是否继续变化,则无法判断平衡状态,故A错误;
B.容器内气体的颜色不再改变,则二氧化氮浓度不变,能够说明该反应达到平衡状态,故B正确;
C.2v(X)=v(Y),没有指出正逆反应速率,无法判断平衡状态,故C错误;
D.该反应为气体体积增大的反应,而气体总质量不变,则混合气体的平均相对分子量为变量,当容器内气体的平均相对分子质量不再改变时,表明正逆反应速率相等,达到平衡状态,故D正确;
E.反应前后气体的总质量不变,容器的体积不变,该反应中混合气体密度为定值,不能根据容器内气体的密度判断平衡状态,故E错误;
故答案为:BD;
(4)由题意,NO2、O2和熔融NaNO3可制作燃料电池,燃料电池中,通入燃料的一极为为负极,通入氧气的一极为正极,则石墨Ⅰ正极,石墨Ⅱ作负极,石墨Ⅱ电极上生成氧化物Y(N2O5),则负极电极反应式为:NO2-e-+NO3-═N2O5。


科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
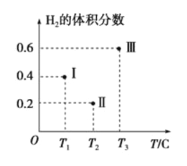
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
(2)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=________________。
(3)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为______,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度_______(选填“增大”、“减小”或“不变”)。
(4)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅰⅰ.![]()
![]()
①写出此条件下,反应A的热化学方程式___________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙烯、乙酸、乙醇的性质类比,有机物的结构简式如图,该物质的化学性质中说法正确的有:

①能加聚也能缩聚;②1mol该有机物分别可跟1 molBr2、4molH2加成;③可使酸性KMnO4溶液褪色;④可跟Na2CO3溶液反应;⑤1mol该有机物可消耗2 mol NaOH;⑥可在碱性条件下水解
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
A.为提高SO2转化率,可以再加入SO2B.平衡时放出197kJ热量
C.平衡时再充入O2,则v正增大,v逆减小D.平衡时SO2和SO3共2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作流程如下:
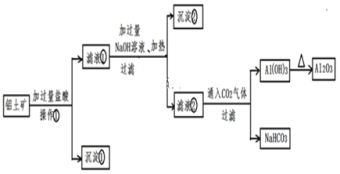
请回答下列问题:
(1)操作①的名称:____________;
(2)沉淀②的化学式:____________;
(3)写出沉淀①与NaOH溶液反应的化学方程式:__________;
(4)写出滤液②里通入过量CO2后生成沉淀的离子方程式: ______,能否将滤液②中通入过量CO2换成加入过量盐酸? ____ (填能或不能),其理由是_______(用化学方程式表示)。
Ⅱ.无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿为原料制备无水AlCl3的工艺流程如下:
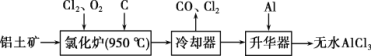
(1)铝在空气中有较强的抗腐蚀性,原因是___________________________。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为___________________________。
(3)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16g无水AlCl3样品溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32g。
①写出上述除杂过程中涉及的离子方程式______________、_______________。
②产品中AlCl3的质量分数为___________。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如下:

(注:SiO2碱溶时转变为铝硅酸钠沉淀)
下列叙述错误的是
A. 操作I增大NaOH溶液用量可提高Al2O3的浸取率
B. 操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C. 通入过量CO2的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 加入的冰晶石目的是降低Al2O3的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1mol·L—1NaOH溶液:K+、Na+、SO42--、CO32—
B. 0.1mol·L—1Na2CO3溶液:K+、Ba2+、NO3—、Cl—
C. 0.1mol·L—1AlCl3溶液:K+、NH4+、F—、SO42—
D. c(H+)/c(OH—) = 1×1014的溶液:Ca2+、Na+、ClO—、NO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com