
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
(2)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=________________。
(3)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为______,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度_______(选填“增大”、“减小”或“不变”)。
(4)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅰⅰ.![]()
![]()
①写出此条件下,反应A的热化学方程式___________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为__________kJ。
【答案】温度升高,反应速率加快 温度升高,有利于平衡反应正向进行 80 kJ·mol1 Cl2+H2O![]() HCl + HClO 增大 正反应 加入少许铁粉或加入少许碘(其他合理设计也可) 4HCl(g)+O2(g)
HCl + HClO 增大 正反应 加入少许铁粉或加入少许碘(其他合理设计也可) 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 31.9
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 31.9
【解析】
(1)可以从速率和平衡两个角度进行分析;
(2)利用盖斯定律解决问题;
(3)反应为可逆反应,利用勒夏特立原理分析离子浓度的变化;
(4)利用勒夏特列原理分析;
(5)利用ΔH=反应物的总键能之和-生成物的总键能进行计算。
(1)两个方面考虑: ①温度越高,化学反应速率越快②由于正反应为吸热反应,温度越高越有利于平衡正向移动;
答案: 温度升高,反应速率加快 温度升高,有利于平衡反应正向进行
(2)已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
根据盖斯定律①×2-②+③可得TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=80 kJ·mol1
答案: 80 kJ·mol1
(3)根据题意可知氯气与水的反应为可逆反应,离子方程式:Cl2+H2O![]() H++Cl-+HClO,在上述平衡体系中加入少量NaOH固体,H++OH-=H2O,生成物浓度减小,平衡正向移动,溶液中Cl—浓度增大;
H++Cl-+HClO,在上述平衡体系中加入少量NaOH固体,H++OH-=H2O,生成物浓度减小,平衡正向移动,溶液中Cl—浓度增大;
答案: Cl2+H2O![]() HCl + HClO 增大
HCl + HClO 增大
(4)Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,CCl4可以萃取碘单质到有机层,溶液中生成物浓度减小,平衡向正反应方向移动;根据勒夏特立原理,可以采用增大生成物浓度(如加入少许碘)或者减小反应物浓度(如加入少许铁粉,铁可以把+3价的铁离子还原为+2价的亚铁离子),使平衡逆向移动;
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,CCl4可以萃取碘单质到有机层,溶液中生成物浓度减小,平衡向正反应方向移动;根据勒夏特立原理,可以采用增大生成物浓度(如加入少许碘)或者减小反应物浓度(如加入少许铁粉,铁可以把+3价的铁离子还原为+2价的亚铁离子),使平衡逆向移动;
答案:正反应 加入少许铁粉或加入少许碘
(5)①依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:
4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
②依据ΔH=反应物的总键能之和-生成物的总键能计算:
4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
4×H-Cl+498-(243×2+4×H-O)=-115.6,得到4×H-O-4×H-Cl=498-486+115.6=127.6
(H-O)-(H-Cl)=31.9
答案:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-
2Cl2(g)+2H2O(g) ΔH=-


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】有机物R结构如图所示,下列说法正确的是( )
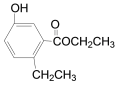
A. R在碱性条件下的水解产物均难溶于水
B. R分子中有7种化学环境均不同的氢原子
C. R和溴水反应后所得产物的化学式为C11H12O3Br2
D. R不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B. 碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C. 二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D. 二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
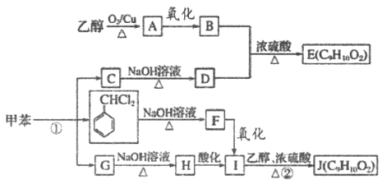
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水。
②G的核磁共振氢谱表明其只有三种不同化学环境的氢。
请回答下列问题:
(1)用甲苯制备TNT的反应方程式:_____________。
(2)D的名称是_____________。
(3)写出B+D→E的反应方程式:_____________,
(4)①的反应条件为_____________。
(5)F的结构简式为_____________。
(6)E、J有多种同分异构体,写出符合下列条件的2种同分异构体的结构简式_____________、_____________。
①与E、J属同类物质
②苯环上有两个取代基
③核磁共振氢谱表明苯环上只有两组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于A(g)+2B(g)![]() 3C(g)的化学反应,下列表示的反应速率最快的是( )
3C(g)的化学反应,下列表示的反应速率最快的是( )
A. v(A)=0.6 mol/(L·min) B. v(B)=0.3 mol/(L·s)
C. v(C)=0.9 mol/(L·min) D. v(C)=1.2 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.用干燥的pH试纸测定氯水的pH
B.配制一定浓度的NaOH溶液,定容时仰视读数,使配制的溶液浓度偏小
C.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
D.将25.0 g CuSO4·5H2O溶于100 mL蒸馏水中,配制100 mL 1.0 mol/L CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于镁、铝的说法正确的是( )
A. 铝制品在空气中能稳定存在是因为铝不活泼
B. 浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应
C. 镁、铝均能与NaOH溶液反应
D. 铝与Fe2O3发生铝热反应是利用了Al的还原性比Fe强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2和N2O4之间发生反应:N2O4![]() 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
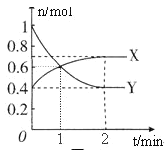
(1)曲线____________(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是________________,该反应达最大限度时Y的转化率_______。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.3 mol·L-1·min-1,乙中y(N2O4)=0.2 mol·L-1·min-1,则__________中反应更快。
(3)下列描述能表示反应达平衡状态的是______________________。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如右图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是______________(填“正极”或“负极”),石墨Ⅱ的电极反应式为_________________________________。
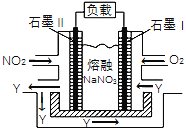
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
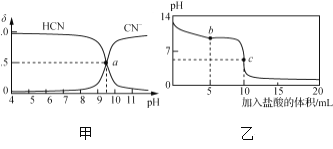
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com