
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
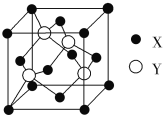
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_________。
(3)Y与Z可形成YZ42-,YZ42-的空间构型为________(用文字描述)。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
(5)请比较亚氯酸(HClO2)和氯酸(HClO3)的酸性强弱:HClO2________HClO3(填“>”“<”或“=”),试从分子结构与性质的关系解释原因_______ 。
【答案】4 ZnS 水分子与乙醇分子之间形成氢键 正四面体 16NA或16×6.02×1023个 < HClO2和HClO3可以分别表示为(HO)ClO和(HO)ClO2,HClO3分子中非羟基氧原子的数目大于HClO2分子中非羟基氧原子的数目,故HClO3分子中Cl的正电荷更高,导致-O-H中的电子更向Cl偏移,因而在水分子作用下,更易电离出H+,即酸性更强(只要答出HClO3分子中非羟基氧原子的数目多,分子中Cl的正电荷更高即可给分)
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,则X为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,然后根据问题分析解答。
根据上述分析可知X是Cu元素,Y是S元素,Z是O元素。
(1)①X离子位于晶胞的顶点和面心,则在1个晶胞中,含有的X离子数目=8×![]() +6×
+6×![]() =4;
=4;
②该晶胞中X离子数目8×![]() +6×
+6×![]() =4;Y离子位于晶胞内,离子数目=4,所以X和Y离子数目之比等于4:4=1:1,故该化合物的化学式为ZnS;
=4;Y离子位于晶胞内,离子数目=4,所以X和Y离子数目之比等于4:4=1:1,故该化合物的化学式为ZnS;
(2)在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大而H2O与H2S分子间无氢键形成,因此溶解度较小;
(3)SO42-中价层电子数=4+![]() ×(6+24×2)=4,且S原子上没有孤电子对,所以SO42-呈正四面体结构;
×(6+24×2)=4,且S原子上没有孤电子对,所以SO42-呈正四面体结构;
(4)在[Zn(NH3)4]Cl2中含有4个配位体NH3,4个配位体NH3的N原子与中心离子Zn2+形成4个配位键,配位键属于σ键;在每个配位体中含有3个N-H共价键,共价键也属于σ键,因此每1 mol配合物[Zn(NH3)4]Cl2中含有的σ键数目为:(3×4+4) mol×NA/mol=16 NA;
(5)HClO2和HClO3都是一元酸,可以分别表示为(HO)ClO和(HO)ClO2,HClO3分子中非羟基氧原子的数目大于HClO2分子中非羟基氧原子的数目,故HClO3分子中Cl的正电荷更高,导致-O-H中的共用电子对更向Cl偏移,因而在水分子作用下,更易电离出H+,即溶液的酸性更强。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是( )
A.Na2CO3溶液中:c(Na+)=2[c(CO32-)+c(HCO3-)]
B.pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③
C.NaY溶液的pH=8,c(Na+)-c(Y-)=9.9×10-7mol/L
D.向0.1mol/L的氨水中加入少量的硫酸铵固体,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A是海水中含量最多的盐,B是最常见的无色液体,E、F、G常温下均为气体,F呈黄绿色,G是最简单的烃,F与G按物质的量之比1∶1反应生成I和J,H是一种既能溶于I溶液又能溶于D溶液的白色固体,C由两种短周期元素组成,其摩尔质量为144 g·mol-1。
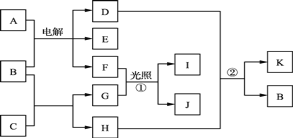
请回答下列问题:
(1)I的电子式为______。
(2)C的化学式为______。
(3)写出反应①的化学方程式_______。
(4)写出反应②的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的说法正确的是 ( )
A.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
B.已知C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.当H为“-”时,表示该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验叙述正确的是( )
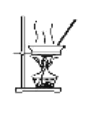
A.将过量硼酸(H3BO3)溶液加入Na2CO3溶液中,无明显现象,但发生了反应
B.根据密度的不同,用加水后再分液的方法可将苯和四氯化碳分离
C.用如图装置蒸干溶液,可制得无水MnCl2固体
D.冷却Cu与浓硫酸反应后的液体,向其中加入水以观察CuSO4溶液的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知![]() ,下列有关叙述错误的是( )
,下列有关叙述错误的是( )

A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,![]()
C.同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中,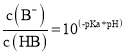
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8的有机物,能使溴的CCl4溶液褪色,也能使酸性KMnO4溶液褪色,并且它的分子中碳上的一个氢原子被氯取代后的一氯代物只有一种,该有机物可能是( )
A.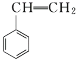 B.
B.![]()
C.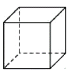 (立方烷)D.
(立方烷)D.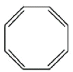 (环辛四烯)
(环辛四烯)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
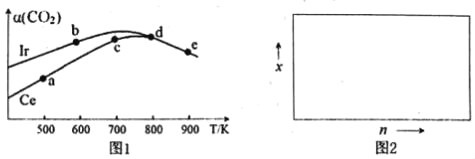
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com