
【题目】下列关于反应热的说法正确的是 ( )
A.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
B.已知C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.当H为“-”时,表示该反应为吸热反应
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,医学上曾用类似G与新制氢氧化铜悬浊液的反应检验糖尿病;E是一种具有香味的物质,各物质间的转化如下图所示![]() 部分反应条件和产物已略去
部分反应条件和产物已略去![]() 。
。
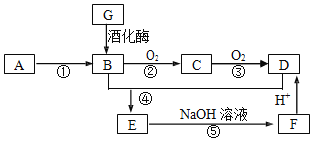
请回答下列问题:
(1)![]() 的结构简式为______
的结构简式为______
(2)写出下列反应的反应类型:![]() ______,
______,![]() ______
______
(3)写出E生成F的反应的离子方程式______
(4)下列说法正确的是______
A. 有机物B、C和D都可以与金属钠反应
B. 用新制的氢氧化铜悬浊液可以鉴别B、C、D
C. E的同分异构体中与E具有相同官能团的有三种(不包括E)
D. G是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) ΔH1=a kJ·mol-1
2NO(g) ΔH1=a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=b kJ·mol-1
2NO2(g) ΔH2=b kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH3=c kJ·mol-1
CO2(g) ΔH3=c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH4
N2(g)+2CO2(g) ΔH4
(1)根据反应①②③,确定反应④中ΔH4=___________ kJ·mol-1。
II. 如图是一个化学过程的示意图,请回答下列问题:
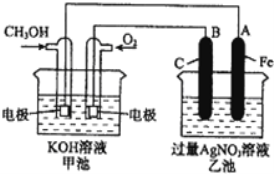
(2)请回答图中甲、乙两池的名称.乙池是_______________装置。
(3)通入甲醇的电极的电极反应式为_________________________________。
(4)乙池中反应的化学方程式为_____________________________________。
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g时,且溶液的体积为500mL,求所得溶液在25℃时的pH=__________ ,甲池中消耗O2为 __________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物![]() 的分子组成,测定装置图所示(夹持仪器、酒精灯等已略去)。
的分子组成,测定装置图所示(夹持仪器、酒精灯等已略去)。
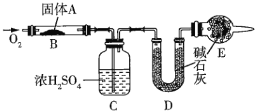
取![]() 放入装置中,通入过量
放入装置中,通入过量![]() 燃烧,生成
燃烧,生成![]() 和
和![]() ,请回答下列有关问题:
,请回答下列有关问题:
(1)通入过量![]() 的目的是_________。
的目的是_________。
(2)![]() 装置的作用是________________,
装置的作用是________________,![]() 装置的作用是___________。
装置的作用是___________。
(3)通过该实验能否确定![]() 中是否含有氧原子________(填“能”或“不能”)。
中是否含有氧原子________(填“能”或“不能”)。
(4)若![]() 的摩尔质量为
的摩尔质量为![]() ,
,![]() 装置增重
装置增重![]() ,
,![]() 装置增重
装置增重![]() ,则
,则![]() 的分子式为________。
的分子式为________。
(5)写出![]() 燃烧的化学方程式:________________。
燃烧的化学方程式:________________。
(6)![]() 可发生水解反应,
可发生水解反应,![]() 可水解生成2种互为同分异构体的产物,且这两种产物均为
可水解生成2种互为同分异构体的产物,且这两种产物均为![]() ,则
,则![]() 在催化剂作用下水解的化学方程式为_____。
在催化剂作用下水解的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
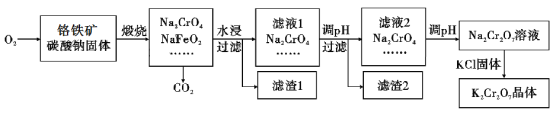
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:
根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
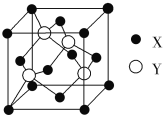
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_________。
(3)Y与Z可形成YZ42-,YZ42-的空间构型为________(用文字描述)。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
(5)请比较亚氯酸(HClO2)和氯酸(HClO3)的酸性强弱:HClO2________HClO3(填“>”“<”或“=”),试从分子结构与性质的关系解释原因_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
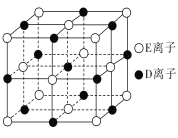
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)用电子式表示C的氢化物的形成过程_________(用元素符号表示)。
(2)F原子的外围电子排布式为________,F的晶体中原子的堆积方式是下图中的______(填“甲”“乙”或“丙”)。

(3)D与E、G与E形成的晶体类型相同,但晶体的配位数不同,其原因是________。
(4)已知DE晶体的晶胞如图所示。若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A-A键的键长为a cm,NA表示阿伏加德罗常数),则该晶胞中含有________个A原子,该晶体的密度是________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com