
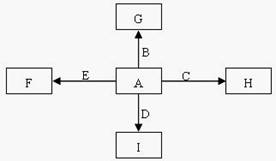
 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;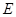 可以发生反应:2E+I
可以发生反应:2E+I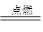 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.科目:高中化学 来源:不详 题型:单选题
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体,HAt不稳定,A gAt感光性很强 ,但不溶于水也不溶于酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.作为催化剂的材料 | B.电子工业上的半导体材料 |
| C.制造农药的材料 | D.制造耐高温材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
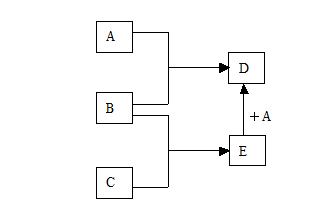
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
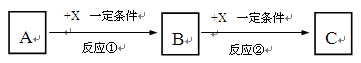
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
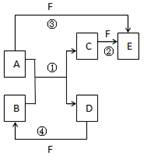
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C.两原子的核外电子排布相同,则一定属于同种元素 |
| D.一种阳离子和一种阴离子的质子数和电子数可能同时相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.甲是BaCl2 | B.丙是Ba(NO3)2 | C.戊是Na2SO4 | D.X是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
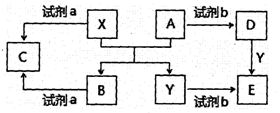
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com