
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯
化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则
溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含
所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实
验现象,证明了乙同学的观点是正确的。
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到得现象。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生
的离子反应方程式为 。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 。
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如下:
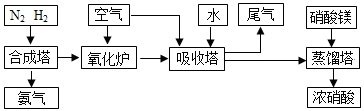
(1)简述原料气N2、H2的 。
(2)下列可以代替硝酸镁加入到蒸馏塔中的是:
A.浓硫酸 B.氯化钙 C.氯化镁 D.生石灰
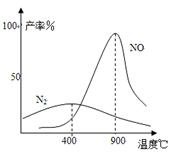
(3)氨气和氧气145℃就开始反应,在不同温度和催化剂时生成不同产物(如图所示):
 4NH3+5O2
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出有关反应化学方程式:
, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程所用仪器,且使用先后顺序正确的是
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④电子天平 ⑤100 mL容量瓶
⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
操作1:将1 L 1.00 mol·L-1的Na2CO3溶液逐滴加入到1 L 1.25 mol·L-1的盐酸中;操作2:将1 L 1.25 mol·L-1的盐酸逐滴加入1 L 1.00 mol·L-1 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是
A.5∶2 B.2∶5 C.1∶1 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应2AB(g) C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0
C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是____ ▲ ____;
②列式并计算该条件下反应的平衡常数K=____ ▲ ____。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率____ ▲ ____(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____ ▲ ____。(填字母)
A.SO2和SO3浓度相等 B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___ ▲ ____K(B)(填“>”、“<”或“=”)。
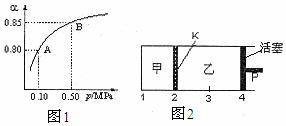
(3)如图2所示,保持温度不变,在一定反 应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲_ ▲ 乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__ _ ▲ ____填:“增大”、“减小”、“不变”、“无法确定”)
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
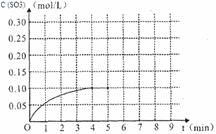
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com