
工业合成氨与制备硝酸一般可连续生产,流程如下:
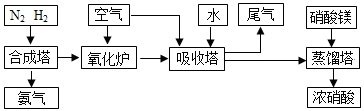
(1)简述原料气N2、H2的 。
(2)下列可以代替硝酸镁加入到蒸馏塔中的是:
A.浓硫酸 B.氯化钙 C.氯化镁 D.生石灰
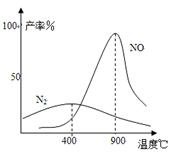
(3)氨气和氧气145℃就开始反应,在不同温度和催化剂时生成不同产物(如图所示):
 4NH3+5O2
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出有关反应化学方程式:
, 。
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在常温、常压下,11.2 L N2含有的分子数为0.5NA
B.标准状况下,22 .4 L H2和O2的混合物所含分子数为NA
.4 L H2和O2的混合物所含分子数为NA
C.标准状况下,18 g H2O的体积是22.4 L
D.1 mol SO2的体积是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为常见的金属单质,根据如图所示的关系:

(1)确定A、B、C、D、E、F的化学式:A________,B________,C________,D________,E________,F________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论
是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。下列说法中不正确的是
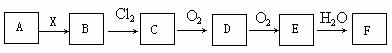
A.B和Cl2反应是氧化还原反应
B.当X是强酸时,C在常温下是气态单质
C.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
D.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F可能是HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述不正确的是
A.常温常压下,16g14CH4所含中子数目为8NA B.1 mol -CH3含有9 NA个电子
C.常温常压下,44 g CO2气体含有氧原子的个数为2 NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.向澄清石灰水中加入等物质的量的NaHCO3溶液:
Ca2++2OH-+ 2HCO3- = CaCO3↓+CO32-+2H2O
B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯
化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则
溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含
所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实
验现象,证明了乙同学的观点是正确的。
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到得现象。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生
的离子反应方程式为 。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
①铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
②Cu(OH)2和HNO3混合:H++OH-===H2O
③Fe与稀硝酸反应 Fe+2H+==Fe2++H2↑
④H2SO3与氢氧化钠混合 H++OH-==H2O
⑤碳酸钡与稀盐酸反应: BaCO3+2H+==Ba2++H2O+CO2↑
⑥SO3溶于水:SO3+H2O==2H++SO42-
A.③⑤⑥ B.⑤⑥ C.①③④ D.③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com