
【题目】氢化阿托醛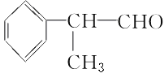 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
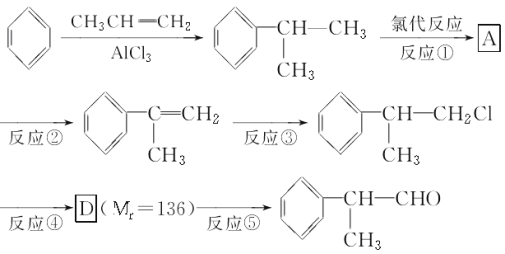
(1)在合成路线上①~⑤反应中,属于消去反应的为________(填反应序号)。
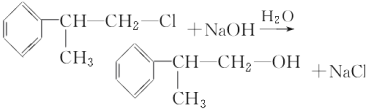
(2)写出反应③、④的化学方程式:
________________________________________________________________________;
________________________________________________________________________。
(3)在一定条件下,D与有机物X发生酯化反应生成E(Mr=164),则X的结构简式为________________________________________________________________________,写出满足下述两个条件的E的两种同分异构体的结构简式:___________________。
a.属于羧酸 b.苯环上的一氯取代物只有一种结构
【答案】(1)② (2)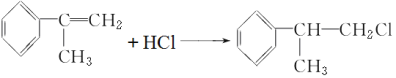 ;
;
 ;
;
(3)HCOOH;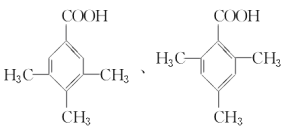
【解析】
试题分析:(1)根据流程图可知,异丙苯发生氯代后生成的A中含有Cl原子,A发生消去反应生成烯烃,烯烃再与HCl发生加成反应生成卤代烃,根据D的相对分子质量可知反应④是卤代烃的水解反应,则D的结构简式为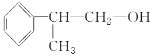 ,D发生催化氧化生成
,D发生催化氧化生成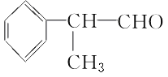 ,所以在合成路线上①~⑤反应中,属于消去反应的为②;
,所以在合成路线上①~⑤反应中,属于消去反应的为②;
(2)根据以上分析可知反应③的方程式为
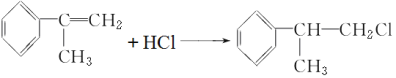 ;反应④的方程式为
;反应④的方程式为
 。
。
(3)D的相对分子质量是136,在一定条件下,D与有机物X发生酯化反应生成E(Mr=164),则X属于羧酸,根据质量守恒定律,该羧酸的相对分子质量是164+18-136=46,所以X是甲酸,结构简式为HCOOH;D的同分异构体中属于羧酸,说明含有羧基,苯环上的一氯取代物只有一种结构,说明结构对称,苯环上只有一种氢原子,则可能的结构简式为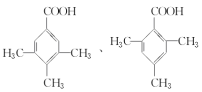 。
。


科目:高中化学 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是( )
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在下列反应中,只起催化作用的是( )
①乙酸和乙醇的酯化反应 ②苯的硝化反应 ③油脂的水解反应 ④淀粉的水解反应
A.①④ B.②④ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s) = CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol1则Q1、Q2的关系为
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 单体的质量之和等于所生成高聚物的质量
B. 单体为一种物质时,则单体发生加聚反应
C. 缩聚反应的单体至少有两种物质
D. 淀粉和纤维素的链节都是C6H10O5,但聚合度不同,彼此不是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
![]()
A. Y元素原子的外围电子排布为4s24p4
B. Y元素在周期表的第三周期ⅥA族
C. X元素所在周期中所含非金属元素最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
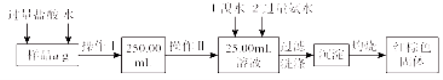
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:

①溶解样品改用了硫酸,而不用盐酸,原因是 。
②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛,在锂离子电池的制备中有重要的作用。用软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。
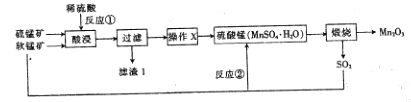
(1)反应①中会生成一种非金属单质,则该非金属单质是_________________,该反应的还原剂是________________。(填化学式)
(2)操作X为蒸发浓缩、__________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,主要目的是________________;
(3)Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为_____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com