
����Ŀ��ij�Ȼ������Ȼ������Ļ�����Ҫ�ⶨ������Ԫ�ص�����������ʵ�鰴���²�����У�
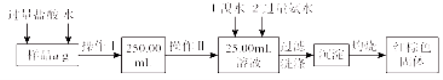
������������̣��ش��������⣺
��1�����������õ��IJ����������ձ����������⣬�������� �� �� (����������)
��2����д��������ˮ���������ӷ�Ӧ����ʽ ��
��3������������ȣ���ȴ�����£�����ƽ����������Ϊb1g���ٴμ��Ȳ���ȴ�����³���������Ϊb2g����b1-b2=0.3g�����������Ӧ���еIJ����� ���������������� W1 g������������Ⱥ������������W2g������Ʒ����Ԫ�ص����������� ����ͬѧ����������Բ������·������ⶨ��

���ܽ���Ʒ���������ᣬ���������ᣬԭ���� ��
��ѡ��Ļ�ԭ���Ƿ������� (��ǡ���)��ԭ���ǣ� ��
�����ζ��õ�c mol/ L KMnO4��ҺbmL������Ʒ����Ԫ�ص����������� ��
���𰸡���1��250mL����ƿ����ͷ�ιܣ���2��2Fe2+ +Br2��2Fe3+ +2Br����
��3���ٴμ�����ȴ��������ֱ������������С��0.1g��![]() ��100%��
��100%��
������������Ժ���KMnO4�ĵζ��и��ţ����������������ԭ����Fe+2Fe3+��3Fe2+����Fe������������ᷴӦ����Fe2+��������Ԫ�صIJⶨ����![]() ��100%
��100%
��������
�����������1������250mLһ�����ʵ���Ũ�ȵ���Һ���貣�������У��ձ�����������250mL����ƿ�ͽ�ͷ�ιܣ�
��2����Br2���������ԣ��ɽ�Fe2+����ΪFe3+�����ӷ���ʽ��2Fe2+ +Br2��2Fe3+ +2Br����
��3��Ϊ�˼��������ٴμ�����ȴ��������ֱ������������С��0.1g������ɫ����ΪFe2O3��������Ԫ�������غ㣬Fe2O3�е���Ԫ�ص�������Ϊ��Ʒ����Ԫ�ص�������Fe2O3����Ԫ�ص�����Ϊ��W2-W1��g��![]() ������Ʒ����Ԫ�ص�����������
������Ʒ����Ԫ�ص�����������![]() ��100%��
��100%��
��������ؾ���ǿ�����ԣ��������ᣬ��Һ�е������ӻᱻ������ʹ���ĸ�����ص���������ʵ�������Ը���������Ϊ�˷�ֹ����������Ժ���KMnO4�ĵζ��и��ţ�
����ԭ�����������������������ԭ������Fe+2Fe3+��3Fe2+����FeҲ������������ᷴӦ����Fe2+��������Ԫ�صIJⶨ��
�����ݷ�Ӧ5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O�����ݶ�����ϵ����õ�������Ԫ����������ΪX%��
5Fe2+ �� 5Fe3+ �� KMnO4
5��56 1
a��X%��![]() c��b��10-3
c��b��10-3
��Ԫ�ص�����������X%=![]() ��
��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯��ͭ��CuH����һ�ֲ��ȶ������ʣ�����������ȼ�գ�Ҳ�����ᷴӦ����CuSO4��Һ����ij��������40~50��ʱ��Ӧ������CuH�����������д�����ǣ� ��
A. ��ij���������л�ԭ��
B. CuH�����ᷴӦ���ܲ���H2
C. CuH������ϡ���ᷴӦ��CuH+3H++NO3-=Cu2++NO��+2H2O
D. CuH��������ȼ�գ�CuH+Cl2=CuCl+HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯����ȩ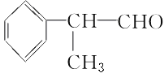 ��һ����Ҫ�Ļ���ԭ�ϣ���ϳ�·�����£�
��һ����Ҫ�Ļ���ԭ�ϣ���ϳ�·�����£�
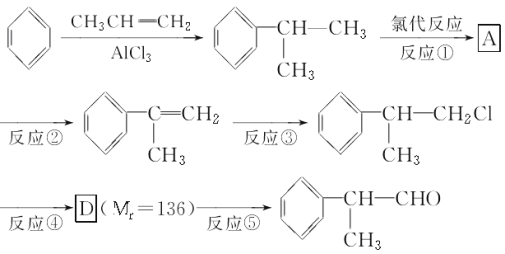
��1���ںϳ�·���Ϣ١��ݷ�Ӧ�У�������ȥ��Ӧ��Ϊ________(�Ӧ���)��
��2��д����Ӧ�����ܵĻ�ѧ����ʽ��
________________________________________________________________________��
________________________________________________________________________��
��3����һ�������£�D���л���X����������Ӧ����E(Mr��164)����X�Ľṹ��ʽΪ________________________________________________________________________��д��������������������E������ͬ���칹��Ľṹ��ʽ��___________________��
a���������� b�������ϵ�һ��ȡ����ֻ��һ�ֽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B�����л�����������������һ��ʱ������A��B�Ժ��ֱ�����ϣ���ȫȼ��ʱ������CO2��������ȣ����������������ǣ� ��
��ͬ���칹�壻
��ͬϵ�
��������ͬ�����ʽ��
����̼������������ͬ
A.�٢ۢ� B���٢� C���٢ڢۢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���¶Ⱥ�ѹǿ�Է�ӦX+Y![]() 2ZӰ���ʾ��ͼ������������ȷ����
2ZӰ���ʾ��ͼ������������ȷ����

A���÷�ӦΪ���ȷ�Ӧ
B������ѹǿ��ƽ�������ƶ�
C��X��Y��Z��Ϊ��̬
D��X��Y��ֻ��һ��Ϊ��̬��ZΪ��̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������л�ԭ��,��ͭ�Ĵ�������, �����ͷ���������Ӧ����A��B��AΪ���,B�ڱ�״����Ϊ��̬���ڴ˷�Ӧ��,����1��������μӷ�Ӧ,����0.75��������μӷ�Ӧ;����8.96 L����(��״��)�μӷ�Ӧ,������0.3 mol A���ڱ�״����,����2.24 L B,��÷�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ mol��
��2���������ʵ���Fe2O3��FeCl3�����ܱչ��м��ȣ���ǡ����ȫ��Ӧ����ֻ����һ�ֲ���X�������ʵ����Ƿ�Ӧ�������ʵ�����1.5����д��X�Ļ�ѧʽ ��
��3���������������ԭ��Ӧ�����ӷ���ʽ��
( )MnO4��+ SO32��+ = Mn2++ SO42��+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ���Ʊ���ϩ�棨CH2=CHC��N������Ȳ������ϩ���������ȡ�
��Ȳ����![]()
��ϩ����������![]()
��1������˵����ȷ���� ��������ѡ����
a��NH4+�ռ乹�ͳ���������
b��CH2=CHCN������ֻ��̼����ԭ��λ��ͬһƽ��
c��C2H2��HCN����������ԭ�Ӿ�λ��ͬһֱ��
d��NH3��������H2O������Ϊ���Ƕ��Ǽ��Է���
��2����NH3��Ϊ�ȵ������������Ϊ ��д��ѧʽ����
��3��1mol��ϩ������к���![]() ������ĿΪ ��
������ĿΪ ��
��4��ͭ����Ũ���Ỻ�������û���Ӧ�����������������H[CuCl2]���ɡ�
���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��H[CuCl2]�ڿ����о��û����ɺ�[Cu(H2O)4]2+����ɫ��Һ��[Cu(H2O)4]2+�Ľṹ����ʾ��ͼ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��M��ԭ�������������������Ԫ�أ���̬Xԭ�ӵ�s��������p��������3����Y��Zͬ���������ڣ���һ�����ܣ�Y��Z��Z��Rͬ���壬M���������29���˶�״̬����ش��������⣺
��1��������XCl3������ԭ���ӻ�����Ϊ___________��RCl2�����幹��Ϊ___________��
��2��H2Z��H2R�ķе�ֱ�Ϊ100����-60��4�����Խ�����ԭ��___________________��
��3��H2RO3��K1��K2�ֱ�Ϊ1��54��10-2��1��02��10-7������ݽṹ�����ʵĹ�ϵ����K1��K2��ԭ��___________________��
��4��Z��M�γɵ�һ�ֻ����ᄃ����ͼ��ʾ��
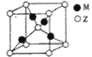
���û�����Ļ�ѧʽΪ________________��
������������Ϊapm����ʽ����þ������ܶ���=_____________gcm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ��
��1.0mL0.10molL-1˫��ˮ
��1.0mL0.20molL-1˫��ˮ
��3.0mL0.10molL-1KMnO4��Һ
��3.0mL0.010molL-1KMnO4��Һ��
����ʵ��������1.0mLϡ��������������������ɫʱ�䳤���ж���Ӧ����������
��1��д��������Ӧ�����ӷ���ʽ_________________________����ij��Ӧ�Ļ�ѧ����ʽΪ2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2��+12H2O����÷�Ӧ��������Ϊ______________������9molH2O2�μӸ÷�Ӧ����Ӧת�Ƶ�����ĿΪ___________��
��2��ij�¶��£���Ҫ̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬��Ӧѡ���Լ�______����ʵ�������������
��3��ij�¶��£�ijͬѧ������2����ѡ���Լ�����ʵ�飬��ɫʱ��Ϊ5s��
��������H2O2��ʾ�ķ�Ӧ����Ϊ___________��
������ʵ������У���ͬѧ������ɫ�仯�����������첢ͻȻ��ɫ������Ϊ�˸�ͬѧ�ֽ�����һ��ƽ��ʵ�飬ֻ�Ǽ�������MnSO4���壬�����Һ������ɫ�����Ʋ���ɫ�仯�����������첢ͻȻ��ɫ�������ԭ��___________��
��4��ijͬѧ�ڲ�ͬ�¶��£��ֱ�ȡ���ݵ������ͬŨ�ȵ�˫��ˮ�����KMnO4��Һ���з�Ӧ�����Ƴ�c��H2O2����ʱ����t���仯��������ͼ��ʾ����A��B�ֱ�Ϊ��ͬ�¶�ʱ�ⶨ�����ߣ���_____���A����B������������Ӧ��ʵ���¶ȸߣ��жϵ�������___________��
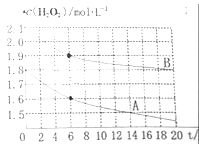
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com