
【题目】氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A. “某物质”具有还原性
B. CuH与盐酸反应可能产生H2
C. CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D. CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】【无机工业流程】

实验室从含碘废液(除H2O外,含有CCl4、I2、I- 等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程为 ;该操作将I2还原为I- 的目的是 。
(2)操作X的名称为____________。

(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO![]() +2IO
+2IO![]() +2H+===I2+5SO
+2H+===I2+5SO![]() +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO![]() 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO![]() 的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是( )
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的4种有机物(氢原子没有画出)
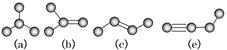
(1)上述有机物中,能使溴水褪色的是__________________(填代号)
(2)上述有机物中与(c)互为同分异构体的是_________________(填代号)
(3)与(a)互为同系物,且相对分子质量最小的有机物的电子式是_____________,其空间构型为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L--1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系是( )
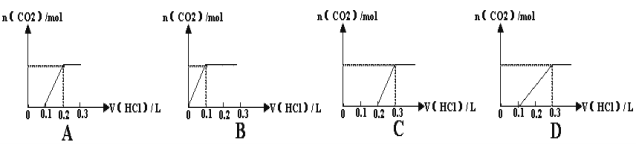
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理废水中Cr2O72-的污染,常加入Na2SO3和H2SO4使之变为Cr3+,被氧化与被还原的离子的物质的量之比为
A.1∶1 B.2∶1 C.3∶1 D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在下列反应中,只起催化作用的是( )
①乙酸和乙醇的酯化反应 ②苯的硝化反应 ③油脂的水解反应 ④淀粉的水解反应
A.①④ B.②④ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
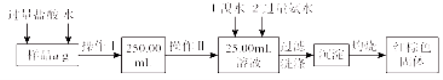
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:

①溶解样品改用了硫酸,而不用盐酸,原因是 。
②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com