
【题目】现有如下溶液:
①1.0mL0.10molL-1双氧水
②1.0mL0.20molL-1双氧水
③3.0mL0.10molL-1KMnO4溶液
④3.0mL0.010molL-1KMnO4溶液。
所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)写出发生反应的离子方程式_________________________;若某反应的化学方程式为2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O,则该反应的氧化剂为______________,若有9molH2O2参加该反应,则反应转移电子数目为___________;
(2)某温度下,若要探究反应物浓度对反应速率的影响,则应选择试剂______进行实验(填序号)。
(3)某温度下,某同学按照(2)中选择试剂进行实验,褪色时间为5s:
①计算以H2O2表示的反应速率为___________;
②进行实验过程中,该同学发现颜色变化会出现先慢后快并突然褪色的现象。为此该同学又进行了一次平行实验,只是加入少量MnSO4固体,结果溶液立即褪色,请推测颜色变化会出现先慢后快并突然褪色的现象的原因___________;
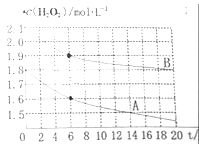
(4)某同学在不同温度下,分别取两份等体积不同浓度的双氧水与等量KMnO4溶液进行反应,绘制出c(H2O2)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则_____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是___________;
【答案】(1)2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O KMnO4、H2O2 14NA
(2)①②④ (3)①3.0×10-3mol·L-1·S-1 ②生成的MnSO4为该反应的催化剂
(4)A A曲线起始浓度小,但在0~6s内平均反应加快,说明其温度高
【解析】
试题分析:现有如下溶液:①1.0mL0.10molL-1双氧水 ②1.0mL0.20molL-1双氧水 ③3.0mL0.10molL-1KMnO4溶液 ④3.0mL0.010molL-1KMnO4溶液。所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)KMnO4溶液氧化H2O2,发生反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;在反应2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O中,KMnO4降低的化合价总数为10,生成氧气共升高14价,结合化合价升降总数相等,可知另有部分H2O2作氧化剂,则该反应的氧化剂为KMnO4、H2O2,若有9molH2O2参加该反应,转移电子的物质的量为14mol,即转移电子数目为14NA;
(2)恒温度下,应选择①②④三种试剂来探究反应物浓度对反应速率的影响;
(3)①根据选择的试剂,当褪色时间为5s是以H2O2表示的反应速率为3.0×10-3mol·L-1·S-1;
②只少量MnSO4固体,结果溶液立即褪色,说明是MnSO4反应催化剂,这是反应溶液颜色变化会出现先慢后快并突然褪色的根本原因;
(4)温度对反应速率的影响远大于浓度对反应速率的影响,且温度越高,反应速率越快,由此可知曲线A所对应的实验温度高,因为A曲线起始浓度小,但在0~6s内平均反应加快,故说明其温度高。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
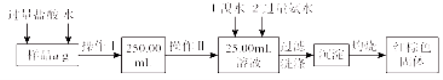
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:

①溶解样品改用了硫酸,而不用盐酸,原因是 。
②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛,在锂离子电池的制备中有重要的作用。用软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。
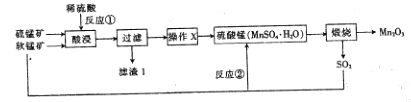
(1)反应①中会生成一种非金属单质,则该非金属单质是_________________,该反应的还原剂是________________。(填化学式)
(2)操作X为蒸发浓缩、__________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,主要目的是________________;
(3)Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某位同学利用家中废旧材料制作了一个可使玩具扬声器发出声音的装置,如图。下列有关该电池工作时的说法正确的是( )
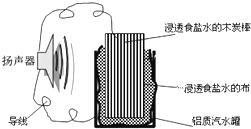
A.木炭棒将逐渐被腐蚀
B.电子流向为铝质汽水罐→导线→食盐水→扬声器→导线→炭棒
C.食盐水中的Na+向炭棒移动
D.炭棒上发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液,以下仪器中不需要用到的是( )
A. 烧瓶 B. 烧杯 C. 容量瓶 D. 玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池连接惰性电极电解一定量的CuSO4溶液,请回答下列问题:
(1)铅蓄电池放电时正极的电极反应式为________________________________;
(2)惰性电极电解CuSO4溶液的离子方程为_____________________;
(3)若电解一段时间后向电解池溶液中加入1molCu(OH)2·CuCO3,可以使该溶液恢复至原来的浓度和体积,则在该电解过程中转移电子的数目为___________,该电解过程中铅蓄电池中消耗的H2SO4和电解池中生成的H2SO4的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 金属元素的最外层电子数不一定小于4
B. 1A族元素形成的单质的熔点随原子序数的递增而降低
C. 同主族第三、第四周期的元素原子序数之差不一定等于18
D. 单质磷的化学性质比氮气活泼,容易与非金属等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+![]() H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com