
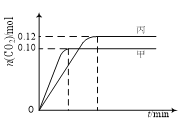
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
【答案】BD
【解析】2NO(g)+2CO(g)![]() N2(g)+2CO2(g),先拐先平,对应温度高,甲状态温度高于丙,T1>T2,此时甲平衡状态二氧化碳物质的量小,说明温度越高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,故A错误;B、乙中可以看做是甲起始量达到平衡状态,再加入0.1molNO和0.1molCO,相当于增大平衡压强,平衡正向进行,达到平衡时,乙中CO2的体积分数比甲中的大,故B正确;C、甲状态下平衡时CO2物质的量为0.10mol,列表计算平衡常数,
N2(g)+2CO2(g),先拐先平,对应温度高,甲状态温度高于丙,T1>T2,此时甲平衡状态二氧化碳物质的量小,说明温度越高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,故A错误;B、乙中可以看做是甲起始量达到平衡状态,再加入0.1molNO和0.1molCO,相当于增大平衡压强,平衡正向进行,达到平衡时,乙中CO2的体积分数比甲中的大,故B正确;C、甲状态下平衡时CO2物质的量为0.10mol,列表计算平衡常数,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol·L-1) 0.1 0.1 0 0
变化量(mol·L-1) 0.05 0.05 0.025 0.05
平衡量(mol·L-1) 0.05 0.05 0.025 0.05
K=![]() =10,T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,Qc=
=10,T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,Qc=![]() =5<K=10,则反应达到新平衡前v(正)>v(逆),故C错误;D、T2℃时,平衡状态CO2物质的量为0.12mol,
=5<K=10,则反应达到新平衡前v(正)>v(逆),故C错误;D、T2℃时,平衡状态CO2物质的量为0.12mol,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 0.2 0.2 0 0
变化量(mol) 0.12 0.12 0.06 0.12
平衡量(mol) 0.08 0.08 0.06 0.12
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 0 0 0.06 0.12
转化量 0.12 0.12 0 0
则起始时向丙中充入0.06mol N2和0.12 mol CO2,反应逆向进行得到平衡状态,和起始量为0.12molNO和0.12molCO达到的平衡等效,所以再和起始量0.2molCO、0.2molNO相比,相当于减少了NO、CO各0.08mol,压强减小平衡逆向进行,所以氮气转化率大于40%,故D正确;故选BD。


科目:高中化学 来源: 题型:
【题目】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是__(用元素符号表示,本小题下同);被选做相对原子质量标准的核素是__(填核素符号);除稀有气体外,原子半径最大的是__,可用于制半导体材料的元素是__,形成化合物中种类最多的元素是__。
(2)最高价氧化物的水化物酸性最强的是__(填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是__(填化学式)。
(3)B和H形成化合物的电子式为_。
(4)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式__。
(5)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是
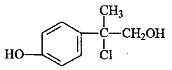
A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的锌与100mL18.5molL﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1molL﹣1.则生成的气体中SO2和H2的体积比为( )
A.1:2B.2:1C.1:4D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )

A. H2O分解为H2与O2时放出热量
B. 生成1mol H2O时吸收热量245 kJ
C. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D. 氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.配制酸性KMnO4标准溶液:下图是配制50 mL酸性KMnO4标准溶液的过程示意图。
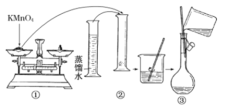
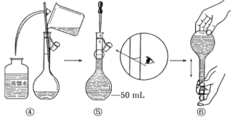
(1)请你观察图示并判断其中不正确的操作有______________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________________(填名称)。
(3)如果按照图示的操作配制溶液,在其他操作均正确的情况下,配制溶液的浓度将______(填“偏大”或“偏小”)。
II.测定血液样品中Ca2+的浓度:取血液样品20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1酸性 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)请写出草酸与酸性KMnO4溶液反应的离子方程式 ____________________________。
(5)滴定时,根据现象_________________________,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为______________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究燃料的燃烧效率和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g) = H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g) = CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式_____________________。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol,H2O(l)= H2O(g) △H= +44.0 kJ/mol,则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H=______________。
CO(g)+3H2(g)△H=______________。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是_____________。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,反应达到平衡时的热量变化是___(填“吸收”或“放出”)___kJ热量。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则 ΔH2=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com